
【题目】下列表格中各项都正确的一组是( )
选项 | 类别 | |||
碱 | 盐 | 电解质 | 非电解质 | |
A | 烧碱 | 小苏打 | BaSO4 | 干冰 |
B | 纯碱 | CaCO3 | NH3·H2O | Fe |
C | 明矾 | 食盐 | 石墨 | 蔗糖 |
D | KOH | CuSO4 | Na2SO4 | NaClO |
A.AB.BC.CD.D
 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:
【题目】已知R2-核外有10个电子,则关于R元素叙述正确的是( )
A. R元素的原子序数是10 B. R2-是O2-
C. R元素最高正化合价为+6 D. R元素位于第二周期第ⅡA族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在密闭容器中充入1molH2和1molI2,压强为P(Pa),并在—定温度下使其发生反应:H2(g)+I2(g) ![]() 2HI(g) △H<0。保持容器内气体压强不变,向其中加入1molN2,反应速率______(填“变大”、“ 变小”或“不变”),平衡_________ 移动(填“向正反应方向”、“ 向逆反应方向”或“不”)。
2HI(g) △H<0。保持容器内气体压强不变,向其中加入1molN2,反应速率______(填“变大”、“ 变小”或“不变”),平衡_________ 移动(填“向正反应方向”、“ 向逆反应方向”或“不”)。
(2)火箭残骸中存在红棕色气体,原因为:N2O4![]() 2NO2(g) △H
2NO2(g) △H
①当温度升高时,气体颜色变深,则反应为_______________( “吸热”或“放热”)反应。
②T℃,将1molN2O4充入恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态是____________
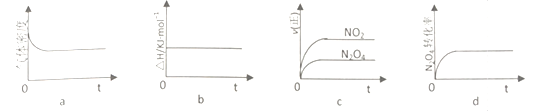
③T℃,上述反应改在体积为1L的恒容密闭容器中进行,平衡常数___________(填“增大”“ 不变”或“减小”)。
(3)已知 4HCl(g)+O2(g) ![]() 2Cl2 (g)+2H2O(g)中 2mol HCl被氧化,放出 57.8kJ 的热量,且部分化学键断裂示意图如下:
2Cl2 (g)+2H2O(g)中 2mol HCl被氧化,放出 57.8kJ 的热量,且部分化学键断裂示意图如下:
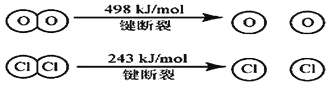
①写出该反应的热化学方程式___________________ 。
②断开1 mol H-O键与断开1 molH-C1键所需能量相差约为_________kJ,H2O中H-O键比HCl中H-Cl键___________(填“强”或“弱”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于分散系的叙述不正确的是( )
A.分散系的分类: ![]()
B.用平行光照射FeCl3溶液和Fe(OH)3胶体,可以加以区分
C.如图显示的是树林的晨曦,该现象与丁达尔效应有关
D.在Fe(OH)3胶体中加入过量硫酸后会出现红褐色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组将V1mL0.50mol/LH2SO4溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验装置和实验结果如下图所示(实验中始终保持V1 +V2=50mL)。回答下列问题:

(1)上图所示实验装置中有一个明显的错误________________。
(2)为了减少实验误差,实验过程中将NaOH溶液________________ (选填“一次”或“分多次”)倒入盛有稀硫酸的小烧杯中。溶液混合后,准确读取混合溶液的____________,记为终止温度。
(3)研究小组做该实验时环境温度________ 22°C(填“高于”、“ 低于”或“等于”),判断的依据是___________________。
(4)由题干及图形可知,V1:V2=_________时,酸碱恰好完全中和,此反应所用NaOH溶液的浓度应为_________ mol/L。
(5)若通过实验测定及有关计算知此反应共放出a kJ的热量.请写出此反应的热化学方程式:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.1 L水中溶解了58.5 g NaCl,该溶液的物质的量浓度为1 mol/L
B.从1 L 2 mol/L的H2SO4溶液中取出0.5 L,该溶液溶质物质的量浓度为1 mol/L
C.0.5 L 2 molL﹣1的BaCl2溶液中,Ba2+和Cl﹣的总数为3×6.02×1023
D.10 g 98%的硫酸(密度为1.84 gcm﹣3)与10 mL18.4 molL﹣1的硫酸的浓度不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知20种氨基酸的平均相对分子质量是128,现有一蛋白质由两条肽链组成,共有肽键98个,则此蛋白质的相对分子质量是( )
A. 12800 B. 12544
C. 11036 D. 12288
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硒(Se)及其化合物在工农业生产中有许多用途。以铜阳极泥(主要成分为Ag2Se、Cu2Se和银、金、铂等)为原料制备纯硒的工艺流程如图所示:

回答下列问题:
(1)“焙烧”时的硫酸浓度最好为_____(填标号)。
A.浓硫酸 B. 20%硫酸 C.50%硫酸 D. 80%硫酸
(2)“焙烧”过程中Cu2Se参与反应时,该反应的氧化产物是_______。
(3)“水吸收”所发生反应的化学方程式为____________。
(4)“过滤”所得粗硒可采用真空蒸馏的方法进行提纯,获得纯硒。真空蒸馏的挥发物中硒含量与温度的关系如图所示:

蒸馏操作中控制的最佳温度是_____(填标号)。
A.455℃ B.462℃ C.475℃ D.515℃
(5)“水浸出”中的炉渣需粉碎,且加入温水进行浸泡,目的是____________________,“浸渣”中含有的金属单质是___________。
(6)若“浸出液”中,c(Ag+)=3.0×10-2 mol/L,则溶液中c(SO42-)最大为___________________(已知:Ksp(Ag2SO4)=1.4×10-5,计算结果保留2位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中蕴含丰富的资源,对海水进行综合利用,可制备一系列物质(见下图),下列说法正确的是

A. 步骤①中,除去粗盐中的SO42-、Ca2+、Mg2+等杂质,加入试剂及相关操作顺序可以是:NaOH溶液→BaCl2溶液→Na2CO3溶液→盐酸→过滤
B. 步骤②中反应利用的原理是:相同条件下NaHCO3的溶解度比NaCl小
C. 步骤③可将MgCl2·6H2O晶体在空气中直接加热脱水
D. 步骤④、⑤、⑥溴元素均被氧化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com