
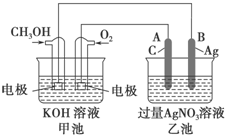
 ��ͼ��һ����ѧ���̵�ʾ��ͼ����֪�׳ص��ܷ�ӦʽΪ2CH3OH+3O2+4KOH�T2K2CO3+6H2O
��ͼ��һ����ѧ���̵�ʾ��ͼ����֪�׳ص��ܷ�ӦʽΪ2CH3OH+3O2+4KOH�T2K2CO3+6H2O���� ��1����װ�������Է��ķ���������ԭ��Ӧ��һ��ȼ�ϵ�أ����ݵ�ʧ�����ж���������
��2��������ӵ�Դ�������ǵ��أ�������ӵ�Դ�ж���������
��3�����ݼ׳غ��ҳص��ܷ�Ӧ�ж�pH�仯��
��� �⣺��1����װ�������Է��ķ���������ԭ��Ӧ��һ��ȼ�ϵ�أ����Լ��ǰѻ�ѧ��ת��Ϊ���ܵ�װ�ã���ԭ��أ�CH3OH�ĵ缫Ϊ�������缫��ӦʽΪCH3OH+8OH--6e-�TCO32-+6H2O���ʴ�Ϊ��ԭ��أ�����CH3OH+8OH--6e-�TCO32-+6H2O��
��2��������ӵ�Դ�������ǵ��أ�������������A��Ϊ�������缫��ӦΪ4OH--4e-�TO2��+2H2O��
�ʴ�Ϊ�����أ�����4OH--4e-�TO2��+2H2O��
��3�����ݼ׳ص��ܷ�ӦʽΪ2CH3OH+3O2+4KOH�T2K2CO3+6H2O�������������أ���pH��С���ҳص��ܷ�ӦʽΪ4AgNO4+2H2O $\frac{\underline{\;ͨ��\;}}{\;}$4Ag+O2��+4HNO3�����������ᣬ����pH��С���ʴ�Ϊ����С����С��
���� ���⿼����ԭ��غ͵��صĹ���ԭ����Ӧ�ã���Ҫ�������ǵ���жϡ��缫�жϣ���ⷽ��ʽ����д�������غ��Ӧ�õȣ���Ŀ�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | pH=4��NaHSO3��Һ�У�c��Na+ ����c��HSO3-����c��H2SO3����c��SO32-�� | |
| B�� | 0.01mol•L-1 ��NaHCO3 ��Һ�д�������ƽ�⣺HCO3-?H++CO3 2-����ˮϡ����Һ�е�HCO3-��H+��CO3 2-Ũ�ȼ��� | |
| C�� | Ũ�Ⱦ�Ϊ0.1mol•L-1 ��CH3COOH��CH3COOK�����Һ�У�2c��H+��+c��CH3COOH��=2c��OH-��+c��CH3COO-�� | |
| D�� | ��Ka��HA��=3.6��10-4��Ka��HB��=1.75��10-5��������ʵ���Ũ�ȵ�NaA��KB��Һ��ȣ�c��Na+ ��-c��A-��=c��K+ ��-c��B-�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | pH=4.5�ķ���֭��c��H+����pH=6.5��ţ����c��H+����100�� | |
| B�� | ��ͬŨ�Ⱥ������ǿ����ǿ����Һ��Ϻ���Һ��PH=7 | |
| C�� | ��NaAlO2��Һ�еμ�NaHCO3��Һ���г������������� | |
| D�� | ����Ӧ2A��g��+B��g��=2C��g����һ����������һ���Է��ķ�Ӧ����÷�ӦΪ���ȷ�Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����������������Һ��Ӧ | B�� | Fe��OH��3��Һ�����ᷴӦ | ||
| C�� | ����������Һ��ϡ���� | D�� | KOH��Һ��ϡ���ᷴӦ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
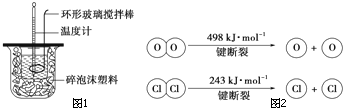 ��Ի�ѧ��Ӧ�е������仯����������⣮
��Ի�ѧ��Ӧ�е������仯����������⣮�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | �Ȼ��� | B�� | ̼������ | C�� | ƫ������ | D�� | �Ȼ��� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com