
减小压强时,对已达化学平衡的反应2X(g)+Y(g) 2Z(g)产生的影响是
2Z(g)产生的影响是
A.逆反应速率增大,正反应速率减小,平衡向逆反应方向移动
B.逆反应速率减小,正反应速率增大,平衡向正反应方向移动
C.正、逆反应速率都减小,平衡向逆反应方向移动
D.正、逆反应速率都增大,平衡向正反应方向移动
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:
研究发现铜具有独特的杀菌功能,能较好地抑制病菌的生长。工业上铜冶炼大致可分为:
①富集:将硫化物矿石进行浮选;
②焙烧,主要反应为:2CuFeS2+4O2→Cu2S+3SO2+2FeO(炉渣);
③制粗铜,在1200℃主要的反应为:2Cu2S+3O2→2Cu2O+2SO2;2Cu2O+Cu2S→6Cu+SO2↑;
④电解精炼,在阴极得到精铜。
下列说法不正确的是
A.上述生产过程中的尾气可以通入氨水中,生产氮肥
B.电解精炼时,粗铜应与外电源的正极相连
C.反应2Cu2O+Cu2S→6Cu+SO2↑中的Cu2O是氧化剂
D.每生产6mol Cu,理论上需消耗11mol O2
查看答案和解析>>
科目:高中化学 来源: 题型:
如下图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极。将直流电源接通后,F极附近呈红色。

请回答:
(1)B极是电源的 极, 丁中X极附近的颜色逐渐变浅,Y极附近的颜色逐渐变深,这表明 在电场作用下向Y极移动。
(2)若甲、乙装置中的C、D、E、F电极均只有一种单质生成时,对应单质的物质的量之比依次为 。
(3)现用丙装置给铜件镀银,则H应该是 (填“镀层金属”或“镀件”),电镀液是 溶液。当乙中溶液的pH是13时(此时乙溶液体积为500mL),丙中镀件上析出银的质量为 ,甲中溶液的pH (填“变大”、“变小”或“不变”)。
(4)乙中发生总反应的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列表述不正确的是
A.福岛核电站泄露的放射性物质131I与127I互为同位素,化学性质几乎相同
B.电子云是处于一定空间运动状态的电子在原子核外空间的概率密度分布的形象化描述
C.凡是中心原子采取sp3杂化方式成键的分子其几何构型都是正四面体
D.钠原子L层共有8种运动状态不同的电子
查看答案和解析>>
科目:高中化学 来源: 题型:
氮元素可以形成多种化合物。回答以下问题:
(1)C、N、O三种元素第一电离能从大到小的顺序是____________。
(2)N≡N的键能为942 kJ·mol-1,N-N单键的键能为247 kJ·mol-1。计算说明N2中的
键更稳定(填“p”或“σ”)。
(3)已知CN-与N2结构相似,推算HCN分子中σ键与p键数目之比为 ;
N2与O22+互为等电子体,O22+的电子式可表示为 。
(4)肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一
种氮的氢化物。
①NH3分子的空间构型是_____________;N2H4分子结构式为_________。
②肼可用作火箭燃料,燃烧时发生的反应是:
N2O4(l)+2 N2H4 (l)===3N2(g)+4H2O(g) △H=-1038.7kJ·mol-1
若该反应中有4mol N-H键断裂,则形成的p键有________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知一定温度下,2X(g)+Y(g)  mZ(g) ΔH=-a kJ· mol -1
mZ(g) ΔH=-a kJ· mol -1
(a>0)。现有甲、乙两容积相等且为固定的密闭容器,保持该温度下向密闭容器甲中通入2 mol X和1 mol Y,达到平衡状态时放出热量b kJ;向乙密闭容器中通入1 mol X和0.5 mol Y,达到平衡时放出热量c kJ,且b>2c。则a、b、m的值或关系正确的是
A. m=4 B. a=b C. a<b/2 D. m≤2
查看答案和解析>>
科目:高中化学 来源: 题型:
下列混合溶液中,各离子浓度的大小顺序正确的是( )
A. 10 mL 0.1 mol ·L-1氨水与10 mL 0.1 mol ·L-1盐酸混合,
c(Cl-)>c(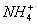 )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
B. 10 mL 0.1 mol ·L-1NH4Cl溶液与5 mL 0.2 mol ·L-1NaOH溶液混合,
c(Na+)=c(Cl-)>c(OH-)>c(H+)
C. 10 mL 0.1 mol ·L-1CH3COOH溶液与5 mL 0.2 mol ·L-1NaOH溶液混合,
c(Na+)=c(CH3COO-)>c(OH-)>c(H+)
D. 10 mL 0.5 mol ·L-1CH3COONa溶液与6 mL 1 mol ·L-1盐酸混合,
c(Cl-)>c(Na+)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关工业生产的叙述正确的是( )
A.合成氨生产过程中将NH3液化分离,会降低反应速率,可提高N2、H2的转化率
B.从海水中提镁过程中,电解熔融MgO可制备Mg
C.电解精炼铜时,同一时间内阳极溶解固体的质量比阴极析出固体的质量小
D.电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极室产生的Cl2进入阳极室
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,在下列给定条件的各溶液中,一定能大量共存的离子组是
A.使酚酞变红色的溶液:Na+、Ba2+、I-、Cl-
B.使甲基橙变红色的溶液:Fe2+、K+、NO3-、SO42-
C.含有0.1 mol·L-1 Fe3+的溶液:Na+、K+、SCN-、NO
D.由水电离产生的c(H+)=10-12mol·L-1的溶液:NH4+、SO42-、HCO3-、Cl-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com