
| A. | 常温常压下,2.3 g Na变成Na2O2时,失去0.2NA个电子 | |
| B. | 常温常压下,32 g氧气和32 g臭氧都含有2NA个氧原子 | |
| C. | 500 mL 0.2 mol/L NaOH溶液中含有NA个Na+离子 | |
| D. | 在20℃、1.01×105Pa时,11.2 L氮气含有NA个氮原子 |
分析 A、求出钠的物质的量,然后根据反应后钠元素变为+1价来分析;
B、氧气和臭氧均由氧原子构成;
C、求出氢氧化钠的物质的量,然后根据1mol氢氧化钠中含1mol钠离子来分析;
D、20℃、1.01×105Pa时,气体摩尔体积大于22.4L/mol.
解答 解:A、2.3g钠的物质的量为0.1mol,而反应后钠元素变为+1价,故0.1mol钠失去0.1mol电子即0.1NA个,故A错误;
B、氧气和臭氧均由氧原子构成,故32g氧气和32g臭氧中所含的氧原子的物质的量均为n=$\frac{32g}{16g/mol}$=2mol,即2NA个,故B正确;
C、氢氧化钠的物质的量n=CV=0.2mol/L×0.5L=0.1mol,而1mol氢氧化钠中含1mol钠离子,故0.1mol氢氧化钠中含0.1mol钠离子,故C错误;
D、20℃、1.01×105Pa时,气体摩尔体积大于22.4L/mol,故11.2L氮气的物质的量小于0.5mol,则含有的氮原子的个数小于NA个,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 在硫酸亚铁溶液中,加入铁粉以防止氧化 | |
| B. | 棕红色NO2加压后颜色先变深后变浅 | |
| C. | SO2催化氧化成SO3的反应,往往需要使用催化剂 | |
| D. | H2、I2、HI平衡混和气加压后颜色变深 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容器内每减少1molA2,同时生成2molAB3 | |
| B. | 混合气体总压强不再改变 | |
| C. | 容器内每减少1molA2,同时消耗3molB2 | |
| D. | 密闭容器内的物质的总质量不再改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LH2O含有的分子数为NA | |
| B. | 通常状况下,NA 个CO2分子占有的体积为22.4L | |
| C. | 物质的量浓度为1mol/L的MgCl2溶液中,含有Cl-个数为2NA | |
| D. | 常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠是银白色金属,密度很大 | |
| B. | 将金属钠放到水中不反应 | |
| C. | 金属钠在空气中燃烧,生成过氧化钠 | |
| D. | 金属钠的熔点很高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化合价升高 | B. | 化合价降低 | C. | 化合价不变 | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
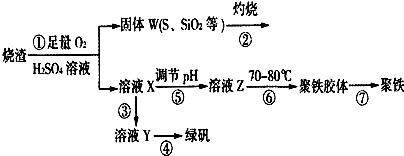
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 粒子半径:S>S2->Cl->F | B. | 酸性:HClO4>H2SO4>H3PO4 | ||
| C. | 氧化性:F2>Br2>I2>S | D. | 离子还原性:S2->I->Br->Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com