
标准状况下H2和Cl2组成的混合气体amol,其中氯气的体积分数为w。经光照后缓缓通入含bmolNaOH的溶液中充分反应,测得最终溶液中含有c molNaClO(c>0),则下列说法正确的是
A.若c>b - a,则 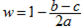 |
B.若a + c>b,则 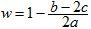 |
| C.若b="a" + c,则 w=0.5 |
D.若a<b-c,则 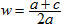 |
B、D
解析试题分析:可能发生的反应为:① H2+Cl2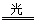 2HCl;②HCl+NaOH=NaCl+H2O;③ Cl2+2NaOH ="NaCl+" NaClO+H2O。混合气体中氯气的物质的量为awmol。因为最终溶液中含有c molNaClO(c>0)说明Cl2对于H2来说是过量的。则根据③可知消耗Cl2的物质的量为cmol;消耗NaOH的物质的量为2cmol。发生①反应的Cl2的物质的量为(aW-c)mol,H2的物质的量为(a-aW)mol。产生的HCl的物质的量为2(aW-c)mol.其消耗的NaOH的物质的量为2(aW-c)mol。若恰好完全反应。则b="2c+2(aW-c)" , (aw-c)mol=(a-aW)mol。2aw=a+c.钠元素的存在形式NaCl、NaClO。b= 2aw。即恰好完全反应时b=a+c。当a+c >b, 即c>b – a时,对于反应③Cl2+2NaOH =NaCl+NaClO+H2O 来说NaOH不足量,n(NaClO)=cmol,消耗的NaOH的物质的量为2cmol,反应②消耗的NaOH的物质的量为(b-2c)mol。HCl的物质的量为(b-2c)mol,由于①反应Cl2过量,所以n(H2)= (b-2c)/2mol.。n(Cl2)=" a-(b-2c)/2mol" ="(2a-b+2c)" /2mol.所以氯气的体积分数w= n(Cl2)÷n(总)= (2a-b+2c)/2mol÷amol=
2HCl;②HCl+NaOH=NaCl+H2O;③ Cl2+2NaOH ="NaCl+" NaClO+H2O。混合气体中氯气的物质的量为awmol。因为最终溶液中含有c molNaClO(c>0)说明Cl2对于H2来说是过量的。则根据③可知消耗Cl2的物质的量为cmol;消耗NaOH的物质的量为2cmol。发生①反应的Cl2的物质的量为(aW-c)mol,H2的物质的量为(a-aW)mol。产生的HCl的物质的量为2(aW-c)mol.其消耗的NaOH的物质的量为2(aW-c)mol。若恰好完全反应。则b="2c+2(aW-c)" , (aw-c)mol=(a-aW)mol。2aw=a+c.钠元素的存在形式NaCl、NaClO。b= 2aw。即恰好完全反应时b=a+c。当a+c >b, 即c>b – a时,对于反应③Cl2+2NaOH =NaCl+NaClO+H2O 来说NaOH不足量,n(NaClO)=cmol,消耗的NaOH的物质的量为2cmol,反应②消耗的NaOH的物质的量为(b-2c)mol。HCl的物质的量为(b-2c)mol,由于①反应Cl2过量,所以n(H2)= (b-2c)/2mol.。n(Cl2)=" a-(b-2c)/2mol" ="(2a-b+2c)" /2mol.所以氯气的体积分数w= n(Cl2)÷n(总)= (2a-b+2c)/2mol÷amol=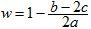 .因此A错误;B正确。C.若b="a" + c,H2和Cl2不仅发生①反应,还发生③反应都则 w>0.5。错误。D. 若a+c<b,即a<b-c则对于反应③Cl2+2NaOH =NaCl+NaClO+H2O 来说NaOH过量,n(NaClO)="cmol" ,该反应消耗的NaOH的物质的量为2cmol。发生①反应的Cl2的物质的量为 (aw-c)mol, H2的物质的量为(a-aw)mol. (aw-c) =(a-aW),2aw=a+c,
.因此A错误;B正确。C.若b="a" + c,H2和Cl2不仅发生①反应,还发生③反应都则 w>0.5。错误。D. 若a+c<b,即a<b-c则对于反应③Cl2+2NaOH =NaCl+NaClO+H2O 来说NaOH过量,n(NaClO)="cmol" ,该反应消耗的NaOH的物质的量为2cmol。发生①反应的Cl2的物质的量为 (aw-c)mol, H2的物质的量为(a-aw)mol. (aw-c) =(a-aW),2aw=a+c,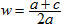 。正确。
。正确。
考点:考查H2和Cl2的混合气体光照后被NaOH溶液吸收时各种物质的相对量的多少的知识。


科目:高中化学 来源: 题型:单选题
已知Ba(AlO2)2可溶于水,向含有1 mol Al2(SO4)3的溶液中加入含有b mol Ba(OH)2 (b≠6)的溶液,所得沉淀的物质的量不可能为
| A.5mol | B.3mol | C.b/2mol | D.5b/3mol |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列关于同温同压下的两种气体 12C18O和14N2的判断正确的是
| A.体积相等时密度相等 |
| B.原子数相等时具有的中子数相等 |
| C.体积相等时具有的电子数相等 |
| D.质量相等时具有的质子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知NH3和HCl都能用来作喷泉实验。若在同温同压下用等体积烧瓶,一个收集满NH3,另一个收集满HCl气体,做喷泉实验,如图所示,喷泉实验停止后,两个烧瓶内溶液的关系是(不考虑溶质的扩散及静止时液面高度的影响)
| A.溶质的物质的量浓度相同、溶质的质量分数不同 |
| B.溶质的质量分数相同,溶质的物质的量浓度不同 |
| C.溶质的物质的量浓度和溶质的质量分数都不同 |
| D.溶质的物质的量浓度和溶质的质量分数都相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
有4.8 g CuO、Fe2O3混合物跟足量CO充分反应后固体减少1.28 g,反应后全部气体用0.6 mol·L-1 Ba(OH)2溶液100 mL吸收。下列有关叙述中正确的是( )
| A.原混合物中CuO与Fe2O3物质的量的比为1∶2 |
| B.原混合物中CuO与Fe2O3的质量比为2∶1 |
| C.吸收CO2后溶液中一定有Ba(HCO3)2 |
| D.反应中生成的CO2体积为1.792 L |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
同温同压下,两个容积相等的储气瓶,一个装有C2H4,另一个装有C2H2`
和C2H6的混合气体,两瓶内的气体一定具有相同的( )
| A.质量 | B.原子总数 |
| C.碳原子数 | D.密度 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
同体积、同物质的量浓度的BaCl2溶液可分别使同体积的Fe2(SO4)3、ZnSO4、K2SO4三种溶液中的SO42-完全沉淀,则三种硫酸盐中金属离子物质的量浓度之比为( )
| A.1:2:3 | B.1:3:6 |
| C.2:3:6 | D.6:2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某工厂废水中含5.00×10-3 mol·L-1的Cr2O72-,其毒性较大。某研究性学习小组为了变废为宝,将废水处理得到磁性材料Cr0.5 Fe1.5FeO4的流程图示意如下: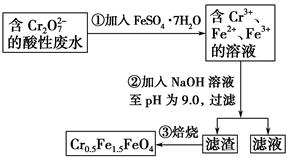
下列有关判断错误的是( )。
| A.操作①中反应的离子方程式为Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O |
| B.操作②所得的滤渣成分主要为Fe(OH)3、Fe(OH)2、Cr(OH)3 |
| C.磁性材料Cr0.5Fe1.5FeO4中,显+3价铁与显+2价铁的质量之比为2∶3 |
| D.若废水中杂质不与绿矾反应,将该1 L废水中的Cr2O72-完全转化为Cr0.5Fe1.5FeO4,理论上需加入绿矾13.9 g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com