
【题目】氯气可以用于制取漂白剂和自来水杀菌消毒。常温下,溶液中Cl2(aq)、HClO和ClO-物质的量分数(α)随pH变化的关系如图所示。
已知,Cl2(g)![]() Cl2(aq)K1=10-1.2
Cl2(aq)K1=10-1.2
Cl2(aq)+H2O![]() HClO+H++Cl-K2=10-3.4
HClO+H++Cl-K2=10-3.4
下列说法正确的是
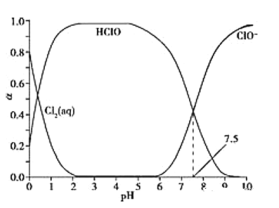
A.Cl2(g)+H2O![]() 2H++ClO-+Cl-K3=10-10.9
2H++ClO-+Cl-K3=10-10.9
B.氯气通入水中,c(HClO)+c(ClO-)<c(H+)-c(OH-)
C.pH=7.0时漂白能力要比pH=6.0时要强
D.氯气处理自来水时,在夏天的杀菌消毒效果要比在冬天好
【答案】B
【解析】
A. Cl2(g)+H2O ![]() 2H++ClO-+Cl-,平衡常数的表达式为K3=
2H++ClO-+Cl-,平衡常数的表达式为K3=![]() ,在pH=7.5时,c(HClO)=c(ClO-),即K3=
,在pH=7.5时,c(HClO)=c(ClO-),即K3=![]() ,Cl2(g)
,Cl2(g) ![]() Cl2(aq) K1=
Cl2(aq) K1=![]() ,Cl2(aq)+H2O
,Cl2(aq)+H2O ![]() HClO+Cl-+H+,K2=
HClO+Cl-+H+,K2=![]() ,取pH=7.5,K3=K1×K2×c(H+)=10-1.2×10-3.4×10-7.5=10-12.1,故A错误;
,取pH=7.5,K3=K1×K2×c(H+)=10-1.2×10-3.4×10-7.5=10-12.1,故A错误;
B. 氯气通入水中,存在电荷守恒:c(H+)=c(Cl-)+c(ClO-)+c(OH-),得出:c(Cl-)+c(ClO-)=c(H+)-c(OH-),氯气与水反应:Cl2+H2O=HCl+HClO,根据物料守恒,c(Cl-)=c(HClO)+c(ClO-),带入上式,得出:c(HClO)+2c(ClO-)=c(H+)-c(OH-),因此有c(HClO)+c(ClO-)<c(H+)-c(OH-),故B正确;
C. 起漂白作用的是HClO,由图像可知,pH=7.0时,c(HClO)比pH=6.0小,因此pH=7.0时漂白能力要比pH=6.0时要弱,故C错误;
D. 夏天相比冬天温度高,并且HClO易分解;温度越高,HClO分解越快。所以,在夏天的杀菌消毒效果要比在冬天差,故D错误;
答案:B。


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
【题目】氮化铝(A1N)是一种新型无机非金属材料。某A1N样品仅含有Al2O3杂质,为测定A1N的含量,设计如下三种实验方案。
已知:AlN+NaOH+H2O=NaAlO2+NH3↑
(方案一)
取一定量的样品,用以下装置测定样品中A1N的纯度(夹持装置已略去)。
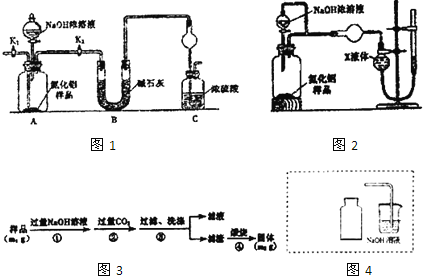
(1)如图1C装置中球形干燥管的作用是___。
(2)完成以下实验步骤:组装好实验装置,首先___再加入实验药品。接下来的实验操作是___,打开分液漏斗活塞,加入浓溶液,至不再产生气体。打开K1,通入氮气一段时间,测定C装置反应前后的质量变化,通入氮气的目的是___。
(3)由于装置存在缺陷,导致测定结果偏高,请提出改进意见____。
(方案二)
用如图2装置测定mg样品中A1N的纯度(部分夹持装置已略去)。
(4)为测定生成气体的体积,量气装置中的X液体可以是___。
a.CCl4 b.H2O c.NH4Cl溶液 d.苯
(5)若mg样品完全反应,测得生成气体的体积为VmL(已转换为标准状况),则A1N的质量分数____。
(方案三)
按如图3步骤测定样品中A1N的纯度:
(6)步骤②生成沉淀的离子方程式为____。
(7)若在步骤③中未洗涤,测定结果将___(填“偏高”“偏低’或“无影响”)。
(8)实验室制取NO2气体。在如图4虚线框内画出用铜与浓硝酸制取和收集NO2的装置简图___(夹持仪器略)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列溶液中有关微粒的物质的量浓度关系正确的是
A.pH=8的CH3COONa溶液:c(CH3COOH)=9.9×10-7 mol·L-1
B.0.1 mol·L-1Na2SO3溶液:c(Na+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
C.0.1 mol·L-1NaHCO3溶液:c(Na+)+c(OH-)=c(HCO3-)+c(H2CO3)+c(H+)
D.0.1 mol·L-1CH3COONa溶液中通入HCl至溶液pH=7:c(Na+)>c(CH3COOH)>c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨和硝酸都是重要的工业原料。
(1)标准状况下,将500 L氨气溶于水形成1 L氨水,则此氨水的物质的量浓度为__mol· L-1(保留三位有效数字)。工业上常用过量氨水吸收二氧化硫,该反应的化学方程式为__。
(2)氨氧化法是工业生产中合成硝酸的主要途径。合成的第一步是将氨和空气的混合气通过灼热的铂铑合金网,在合金网的催化下,氨被氧化成一氧化氮,该反应的化学方程式为__。
下列反应中的氨与氨氧化法中的氨作用相同的是__。
A.2Na+2NH3===2NaNH2+H2↑ B.2NH3+3CuO===3Cu+N2+3H2O
C.4NH3+6NO===5N2+6H2O D.HNO3+NH3===NH4NO3
工业中的尾气(假设只有NO和NO2)用烧碱进行吸收,反应的离子方程式为2NO2+2OH﹣===NO2-+NO3-+H2O和NO+NO2+2OH﹣===□ +H2O(配平该方程式)。______________
(3)向27.2 g Cu和Cu2O的混合物中加入某浓度的稀HNO3500 mL,反应过程中产生的气体只有NO。固体完全溶解后,在所得溶液(金属阳离子只有Cu2+)中加入1 L 1 mol·L-1的NaOH溶液使金属离子恰好完全沉淀,此时溶液呈中性,所得沉淀质量为39.2 g。
①Cu与稀HNO3反应的离子方程式为__。
②Cu与Cu2O 的物质的量之比为__。
③HNO3的物质的量浓度为__mol·L-1。
(4)有H2SO4和HNO3的混合溶液20 mL,加入0.25 molL﹣1Ba(OH)2溶液时,生成沉淀的质量w(g)和Ba(OH)2溶液的体积V(mL)的关系如图所示(C 点混合液呈中性)。则原混合液中H2SO4的物质的量浓度为__mol·L-1,HNO3的物质的量浓度为__mol·L-1。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标况下,a克气体X与b克气体Y的分子数相同,下列说法错误的是( )
A.X和Y的式量之比是a:b
B.气体X和气体Y的密度比为b:a
C.1g气体X和1g气体Y的分子数之比是a:b
D.1mol气体X和1mol气体Y的质量比是a:b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在T ℃时,铬酸银(Ag2CrO4)在水溶液中的沉淀溶解平衡曲线如图所示,下列说法中不正确的是

A.向饱和Ag2CrO4溶液中加入固体K2CrO4能使溶液由Y点变为X点
B.T℃时,在Y点和Z点,Ag2CrO4的Ksp相等
C.T℃时,Ag2CrO4 的 Ksp数值为 1×10-11
D.图中a=![]() ×10-4
×10-4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某核素![]() 的氯化物XCl2 0.95g配成溶液后,需用1mol/L的硝酸银溶液20mL才能把氯离子完全沉淀下来,试计算:
的氯化物XCl2 0.95g配成溶液后,需用1mol/L的硝酸银溶液20mL才能把氯离子完全沉淀下来,试计算:
(1)X的质量数为_________。
(2)若X的核内中子数为12,求47.5gXCl2中所含质子的物质的量是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋是一个巨大的资源宝库,海水开发利用的部分过程如图所示。下列有关说法不正确的是( )
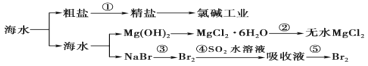
A.①粗盐制精盐除采用过滤泥沙外,还必须除去 Ca2+、Mg2+、SO42-等杂质
B.工业生产中常选用石灰乳作为 Mg2+的沉淀剂,并对沉淀进行洗涤
C.第②步的反应是将 MgCl26H2O 晶体在空气中直接加热脱去结晶水得无水 MgCl2
D.第③步到第⑤步空气吹出法提取海水中溴通常使用 SO2 作还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年7月1日起,上海进入垃圾分类强制时代,随后西安等地也纷纷开始实行垃圾分类。这体现了我国保护环境的决心,而环境保护与化学息息相关,下列有关说法错误的是(![]() )
)
A.废弃的聚乙烯塑料属于白色垃圾,不能使溴水褪色
B.可回收的易拉罐中含金属铝,可通过电解熔融氧化铝制取
C.废旧电池中含有镍、镉等重金属,不能用填埋法处理
D.含棉、麻、丝、毛及合成纤维的废旧衣物燃烧处理时都只生成CO2和H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com