
【题目】(2分)N2H4是一种高效清洁的火箭燃料.0.25mol N2H4(g)完全燃烧生成氮气和气态水时,放出133.5kJ热量.则下列热化学方程中正确的是( )
A.![]() N2H4(g)+
N2H4(g)+![]() O2(g)=
O2(g)=![]() N2(g)+H2O(l)△H=+257kJmol﹣1
N2(g)+H2O(l)△H=+257kJmol﹣1
B.N2H4(g)+O2(g)=N2(g)+2H2O(l)△H=﹣133.5kJmol﹣1
C.N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=+534kJmol﹣1
D.N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=﹣534kJmol﹣1
【答案】D
【解析】
试题分析:根据热化学方程式的意义以及热化学方程式的书写方法来写.
解;A、0.25mol N2H4(g)完全燃烧生成氮气和气态水时,放出133.5kJ热量,其焓变是负值,故A错误;
B、0.25mol N2H4(g)完全燃烧生成氮气和气态水时,放出133.5kJ热量,则1mol N2H4(g)完全燃烧生成氮气和气态水时,放出133.5kJ×4=534kJ的热量,故B错误;
C、N2H4(g)完全燃烧生成氮气和气态水时,放出热量,其焓变是负值,故C错误;
D、0.25mol N2H4(g)完全燃烧生成氮气和气态水时,放出133.5kJ热量,则1mol N2H4(g)完全燃烧生成氮气和气态水时,放出133.5kJ×4=534kJ的热量,热化学方程式为:N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=﹣534kJmol﹣1,故D正确.
故选D.


 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是:
A. 共价化合物中可能含有离子键
B. 区别离子化合物和共价化合物的方法是看其水溶液是否能够导电
C. 离子化合物中只含有离子键
D. 离子化合物在熔融状态下能电离出自由移动的离子,而共价化合物不能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)常温下,已知0.1mol﹒L-1一元酸HA溶液中c(OH-)/c(H+)=1×10-8。
① 常温下,0.1 mol﹒L-1 HA溶液的pH=_________;设计一个简单实验证明HA是强酸还是弱酸_________。
② pH=3的HA与pH= 11的NaOH溶液等体积混合后,溶液中4种离子物质的量浓度大小关系是:______________。
(2)常温下,向pH=a的氨水中加入等体积盐酸时,溶液呈中性,则此盐酸的pH______________14—a (>、<、=)
(3)向物质的量浓度均为0.01 mol﹒L-1的MnCl2和BaCl2混合溶液中,滴加Na2CO3溶液,先沉淀的离子是______________,当两种难溶电解质共存时,溶液中c(Ba2+)/c(Mn2+) 。
(此温度下,Ksp(BaCO3)=8.1×10-9、Ksp(MnCO3)=1.8×10-11)
(4)己知常温下CH3COOH的电离平衡常数为1.7×10-5,则该温度下CH3COO-的水解平衡常数等于____________(保留小数点后两位数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下反应中属于放热反应的是
A. 氢氧化钾与硝酸反应 B. 焦炭在高温下与水蒸气反应
C. 石灰石分解成氧化钙和二氧化碳 D. Ba(OH)2·8H2O与NH4Cl的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2015海南卷】氨是合成硝酸、铵盐和氮肥的基本原料,回答下列问题:
(1)氨的水溶液显弱碱性,其原因为 (用离子方程式表示),0.1 mol·L-1的氨水中加入少量的NH4Cl固体,溶液的PH (填“升高”或“降低”);若加入少量的明矾,溶液中的NH4+的浓度 (填“增大”或“减小”)。
(2)硝酸铵加热分解可得到N2O和H2O,250℃时,硝酸铵在密闭容器中分解达到平衡,该分解反应的化学方程式为 ,平衡常数表达式为 ;若有1mol硝酸铵完全分解,转移的电子数为 mol。
(3)由N2O和NO反应生成N2和NO2的能量变化如图所示,若生成1molN2, 其△H= kJ·mol-1。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学反应与能量的说法正确的是 ( )
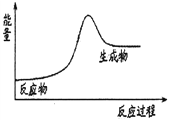
A. 放热反应在常温下一定很容易发生
B. 化学反应一定既伴随着物质变化又伴随着能量变化
C. 石灰石分解反应的能量变化可以用右图3表示
D. 反应物所具有的总能量高于生成物所具有的总能量的反应为吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是中学教材中元素周期表的一部分,其中标出A-Q14种元素,试回答下列问题:[(1) (2)问用具体的元素符号或离子符号或化学式回答]
A | B | C | D | ||||||||||||||
E | F | G | H | I | J | K | L | ||||||||||
P | Q |
(1)在上表所列出的短周期元素中
①性质最不活泼的是_______;②原子半径最大的是_____(除稀有气体元素)
③形成的气态氢化物最稳定的是_______;
④最高价氧化物对应的水化物中酸性最强的是_______碱性最强的是_______。
⑤形成的阴离子还原性最弱的是_______,阳离子半径最小的是_______。
(2)用电子式表示F与D形成化合物的过程
________________________________________________________________________;
(3)设P的原子序数为Z,则F的原子序数为___________,Q的原子序数为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com