
A、向碳酸氢钙溶液中加入过量的氢氧化钠:Ca2++2OH-+2HCO
| ||||
B、等体积等物质的量浓度的氢氧化钡溶液与碳酸氢铵溶液混合:Ba2++2OH-+NH
| ||||
| C、氢氧化铝与足量的盐酸反应:Al(OH)3+3H+=Al3++3H2O | ||||
D、向Na2SiO3溶液中通入过量CO2:SiO
|
- 3 |
2- 3 |
+ 4 |
- 3 |


科目:高中化学 来源: 题型:
| A、定容到刻度线时要使视线与凹液面的最低处水平相切 |
| B、用蒸馏水洗涤容量瓶后必须将容量瓶烘干 |
| C、为了便于操作,浓溶液稀释或固体溶解可直接在容量瓶中进行 |
| D、定容时不小心加水过量,用胶头滴管将水吸出即可 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 甲 | 乙 | 丙 | |
| A | NO2 | SO2 | BaCl2 |
| B | HCl | CO2 | 石灰水 |
| C | CO2 | SO2 | 石灰水 |
| D | CO2 | NH3 | CaCl2 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、8:?11:?14 |
| B、4:?22:?7 |
| C、1:?2:?1 |
| D、2:?1:?2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③④⑤ | B、①②③④ |
| C、①②④ | D、③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加乙醇、浓硫酸,加热 |
| B、加NaOH溶液,充分振荡后,分液 |
| C、直接分液 |
| D、加饱和Na2CO3溶液,充分振荡后,分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
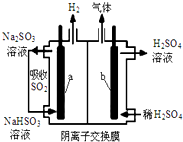 电解法在污染处理上有广泛应用,下面是两例具体应用.
电解法在污染处理上有广泛应用,下面是两例具体应用.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com