
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是
①加入铝粉只有氢气产生的溶液中:Na+、SO42-、NO3-、Mg2+
②pH=11的溶液中: ![]() 、Na+、AlO2-、NO3-、S2-、
、Na+、AlO2-、NO3-、S2-、![]()
③水电离的H+浓度为10-12mol·L-1的溶液中:Cl-、![]() 、NO3-、
、NO3-、![]()
④加入Mg能放出H2的溶液中:Mg2+、NH4+、Cl-、K+、![]()
⑤使甲基橙变黄的溶液中:Fe2+、MnO4-、NO3-、Na+、![]()
⑥中性溶液中:Fe3+、Na+、NO3-、Cl-
A. ①③⑤ B. ②④ C. ①②④ D. ②④⑥
 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 配置一定物质的量浓度的溶液时,需要用到玻璃棒、胶头滴管
B. 用湿润的pH试纸测量稀氢氧化钠溶液的pH,测量值偏大
C. 可用焰色反应鉴别氯化钠和碳酸钠
D. 用分液的方法从含有少量氯化钠的硝酸钾溶液中提取硝酸钾
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25 ℃时,将a g NH3完全溶于水,得到V mL pH=8的氨水,假设该氨水的密度为ρ g·cm-3,溶质的质量分数为ω,其中含NH![]() 的物质的量为b mol,下列叙述中一定正确的是( )
的物质的量为b mol,下列叙述中一定正确的是( )
A. 溶质的质量分数为ω=![]() ×100%
×100%
B. 溶质的物质的量浓度c=![]() mol·L-1
mol·L-1
C. 溶液中c(OH-)=![]() mol· L-1
mol· L-1
D. 上述溶液中再加入V mL水后,所得溶液的质量分数大于0.5 ω
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeCl3在现代工业生产中应用广泛。经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华。工业上,向500—600℃的铁屑中通入氯气可生产无水氯化铁;向炽热铁屑中通入氯化氢可以生产无水氯化亚铁。某化学研究性学习小组模拟工业生产流程制备无水FeCl3并对产物做了如下探究实验,请回答下列问题:
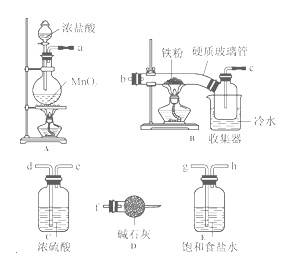
(1)装置的连接顺序为a → (用b、c…h表示)。
(2)i.A中装置气密性检验方法 。
ii.D中碱石灰的作用是 。
(3)反应结束后,生成的烟状FeCl3大部分进入收集器,少量沉积在反应管B中硬质玻璃管的右端。要使沉积得FeCl3进入收集器,需进行的操作是 。
(4)反应一段时间后熄灭酒精灯,冷却后将硬质玻璃管及收集器中的物质一并快速转移至锥形瓶中,加入过量的稀盐酸和少许植物油(反应过程中不振荡),充分反应后,进行如下实验:
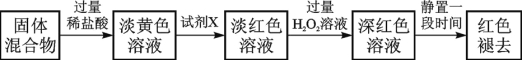
已知红色褪去的同时有气体生成,经检验为O2。该小组同学对红色褪去的原因进行探究。
①取褪色后溶液三份,第一份滴加FeCl3溶液无明显变化;第二份滴加试剂X,溶液出现红色;第三份滴加稀盐酸和BaCl2溶液,产生白色沉淀。
②另取同物质的量浓度的 FeCl3溶液滴加2滴试剂X,溶液变红,再通入O2,无明显变化。
实验①说明 ;
实验②的目的是 ;
得出结论: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列条件的离子反应方程式不正确的是( )
A.向Mg(HCO3)2溶液中加入过量的NaOH溶液:
Mg2++2HCO3-+4OH-=Mg(OH)2↓+2CO32-+2H2O
B.FeBr2溶液中通入等物质的量Cl2:2Fe2++![]() +2Cl2=2Fe3++Br2+
+2Cl2=2Fe3++Br2+![]()
C.酸性KMnO4溶液中加H2O2,紫色褪去:2MnO4-+H2O2+6H+=2Mn2++3O2↑+4H2O
D.向CuSO4溶液中加入Na2O2:2Na2O2+2Cu2++2H2O=4Na++2Cu(OH)2↓+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯酸镁常用作催熟剂、除草剂等,实验室制备Mg(ClO3)2·6H2O的流程如下:
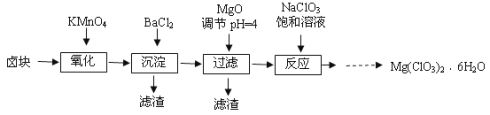
已知:①卤块主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质。
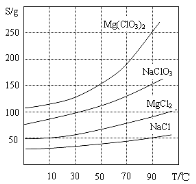
②四种化合物的溶解度(S)随温度(T)变化曲线如图所示。
(1)过滤所需要的主要玻璃仪器有 。
(2)加MgO后过滤所得滤渣的主要成分的化学式为 。
(3)加入NaClO3饱和溶液后发生反应的化学方程式为 ,再进一步制取Mg(ClO3)2·6H2O的实验步骤依次为:
①蒸发结晶;② ;洗涤;
③将滤液冷却结晶;④过滤、洗涤。
(4)产品中Mg(ClO3)2·6H2O含量的测定:(已知Mg(ClO3)2·6H2O的摩尔质量为299 g/mol)
步骤1:准确称量3.50 g产品配成100 mL溶液。
步骤2:取10.00 mL于锥形瓶中,加入10.00 mL稀硫酸和20 .00 mL 1.000 mol·L-1的FeSO4溶液,微热。
步骤3:冷却至室温,用0.100 mol/L K2Cr2O7 溶液滴定剩余的Fe2+至终点。反应的方程式为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O。
步骤4:将步骤2、3重复两次,平均消耗K2Cr2O7 溶液15.00 mL。
① 写出步骤2中发生反应的离子方程式 ;
② 产品中Mg(ClO3)2·6H2O的质量分数为 。(保留到小数点后一位)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知
Fe(s)+CO2(g)![]() FeO(s)+CO(g) K1 ①
FeO(s)+CO(g) K1 ①
Fe(s)+H2O(g)![]() FeO(s)+H2(g) K2 ②
FeO(s)+H2(g) K2 ②
H2(g)+CO2(g)![]() H2O(g)+CO(g)K3 ③
H2O(g)+CO(g)K3 ③
又已知不同温度下,K1、K2值如右表:
温度/℃ | K1 | K2 |
500 | 1.00 | 3.15 |
700 | 1.47 | 2.26 |
900 | 2.40 | 1.60 |
(1)判断反应③达到化学平衡状态的依据是____________。
a.混合气体的平均摩尔质量不变
b.混合气体中c(CO)不变
c.v(H2O)正=v(H2)逆
d.断裂2 mol H—O键的同时生成1 mol H—H键
(2)若500 ℃时进行反应①,CO2起始浓度为2 mol·L-1,2分钟后建立平衡,则CO2转化率为________,用CO表示的速率为________________。
(3)下列图象不符合反应②的是___________(填序号)(图中v是速率,φ为混合物中H2的体积百分含量)。
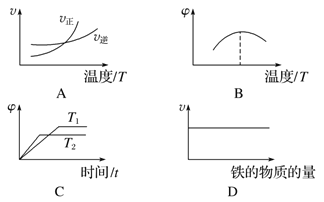
(4)900 ℃进行反应③,其平衡常数K3为____________(求具体数值),焓变ΔH__________0(填“>”“=”或“<”),理由是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com