
【题目】下列各组微粒具有相同的电子数的是( )
A.Ar、H2O2 和 C2H6B.CH4、Na+和 K+
C.SiH4、Al3+ 和 Ca2+D.OH﹣,S2﹣ 和 NH3
 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增加。m、p、r是由这些元素组成的二元化合物,n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性,0.01mol·L-1r溶液的pH为2,s通常是难溶于水的混合物。上述物质的转化关系如图所示。下列说法正确的是( )

A. 原子半径的大小W <X<Y B. 元素的非金属性Z>X>Y
C. Y的氢化物常温常压下为液态 D. X的最高价氧化物的水化物为强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,水溶液中H+和OH﹣的浓度变化曲线如图,下列说法正确的是( ) 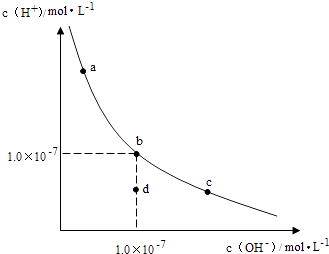
A.升高温度,可能引起由c向b的变化
B.该温度下,水的离子积常数为1.0×10﹣13
C.该温度下,加入FeCl3可能引起由b向a的变化
D.该温度下,稀释溶液可能引起由c向d的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N、P、As、Ga、Cr等元素化合物种类繁多,具有重要的研究价值和应用价值。请回答下列问题:
(1)N元素与Al、Si等元素在一定条件下生成AlN和Si3N4 , 实验测得二者在真空条件下的稳定存在的最高温度2200℃和1900℃,硬度类似金刚石,常用作耐高温和耐磨材料。请推测它们属于晶体类型。
(2)PCl3和PCl5是磷元素形成的两种重要化合物,请根据价电子互斥理论推测PCl3的空间构型。
(3)As的核外电子排布式中不同类型(s、p、d、f等)的电子比是 。
(4)Cr元素价电子排布式为。
(5)砷化镓以第三代半导体著称,性能比硅更优良,广泛用于雷达、电子计算机、人造卫星、宇宙飞船等尖端技术中已知砷化镓的晶胞结构如右图所示,则砷化镓晶胞结构与NaCl晶胞(填“相同”或“不同”)。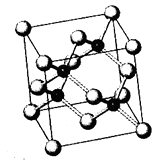
(6)根据As和Ga在元素周期表中的位置判断,第一电离能AsGa(填“<”“>”或“=”)。
(7)(CH3)3Ga中镓原子的杂化类型为。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:① 
② ![]()
HPE是合成苯氧基丙酸类除草剂的重要中间体,其合成路线如下:
据此回答下列问题:
(1)B中含有的官能团名称为 , D的结构简式为。
(2)C + E →F的反应类型为。
(3)M的核磁共振氢谱中各吸收峰的面积之比为。
(4)写出G + M → HPE的化学方程式。
(5)X是G的同分异构体,其中满足以下条件的X共有种,写出其中一种X的结构简式。
A.苯环上有3个取代基且苯环上的一氯取代物有两种
B.遇FeCl3溶液发生颜色反应
C.X不能与NaHCO3反应产生CO2
D.1 mol X最多能和3 mol NaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
(1)Ⅰ.下列有关叙述正确的是( )
A.碱性锌锰电池中,MnO2是催化剂
B.银锌纽扣电池工作时,Ag2O被还原为Ag
C.放电时,铅酸蓄电池中硫酸浓度不断增大
D.电镀时,待镀的金属制品表面发生还原反应
(2)Ⅱ.锌是一种应用广泛的金属,目前工业上主要采用“湿法”工艺冶炼锌,某含锌矿的主要成分为ZnS(还含少量FeS等其他成分),以其为原料冶炼锌的工艺流程如图所示:
回答下列问题:
硫化锌精矿的焙烧在氧气气氛的沸腾炉中进行,所产生焙砂的主要成分的化学式为。
(3)焙烧过程中产生的含尘烟气可净化制酸,该酸可用于后续的操作。
(4)浸出液“净化”过程中加入的主要物质为 , 其作用是。
(5)电解沉积过程中的阴极采用铝板,阳极采用Pb-Ag合金惰性电极,阳极逸出的气是。
(6)改进的锌冶炼工艺,采用了“氧压酸浸”的全湿法流程,既省略了易导致空气污染的焙烧过程,又可获得一种有工业价值的非金属单质。“氧压酸浸”中发生主要反应的离子方程式为。
(7)我国古代曾采用“火法”工艺冶炼锌,明代宋应星著的《天工开物》中有关于“升炼倭铅”的记载:“炉甘石十斤,装载入一泥罐内,……,然后逐层用煤炭饼垫盛,其底铺薪,发火煅红,……,冷淀,毁罐取出,……,即倭铅也。”该炼锌工艺过程主要反应的化学方程式为。(注:炉甘石的主要成分为碳酸锌,倭铅是指金属锌)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某500 mL溶液中含01 mol Fe2+、02 mol Fe3+,加入02 mol铁粉,待Fe3+ 完全还原后,溶液中Fe2+的物质的量浓度为(假设反应前后体积不变)
A. 04 mol / L B. 0.6 mol / L C. 0.8 mol / L D. 1.0 mol / L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:
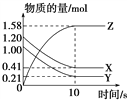
下列描述正确的是( )
A. 反应的化学方程式为X(g)+Y(g) ![]() Z(g)
Z(g)
B. 反应开始到10 s,用Z表示的反应速率为0.158 mol·L-1·s-1
C. 反应开始到10 s,X的物质的量浓度减少了0.79 mol·L-1
D. 反应开始到10 s,Y的转化率为79.0%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com