(1)0.5mol H2O的质量为______,其中共含有______个原子(用阿伏伽德罗常数表示).
(2)质量都是50g的 HCl、NH3、CO2、O2四种气体中,含有分子数目最少的是______(填分子式,下同),在相同温度和相同压强条件下,体积最大的是______.
(3)在______mL 0.2mol/L NaOH溶液中含1g溶质;配制500mL 0.2mol/L CuSO4溶液,需要CuSO4?5H2O______g.
(4)现用Zn与实验室中的盐酸反应制取4.48L H2(标准状况).如果选用所贴标签为2.0mol?L-1的盐酸,至少需该盐酸______ml.
解:(1)0.5mol H
2O的质量为:0.5mol×19g/mol=9g,含原子个数为:0.5N
A×3=1.5N
A,
故答案为:9g;1.5N
A;
(2)质量都是50g的 HCl、NH
3、CO
2、O
2四种气体的物质的量分别为:n(HCl)=
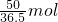
;
n(NH
3)=
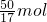
;
n(CO
2)=
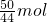
;
n(O
2)=
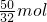
.
物质的量越小,分子数越少,在相同温度和相同压强条件下,物质的量越大,体积越大,
所以含有分子数目最少的是CO
2,在相同温度和相同压强条件下,体积最大的是NH
3,
故答案为:CO
2;NH
3;
(3)1gNaOH的物质的量为

=0.025mol,
则有:0.2mol/L=

,V=0.125L,即125ml,
500mL 0.2mol/L CuSO
4溶液,n(CuSO
4?5H
2O)=0.5L×0.2mol/L=0.1mol,
m(CuSO
4?5H
2O)=0.1mol×250g/mol=25g,
故答案为:125;25;
(4)根据化学方程式计算:
Zn+2HCl═ZnCl
2+H
2↑
2mol 22.4L
2.0mol/L×V 4.48L
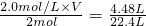
V=0.2L,即200ml,
故答案为:200.
分析:(1)根据m=n?M计算质量,根据N=n?N
A计算原子个数;
(2)根据质量计算物质的量,物质的量越小,分子数越少,物质的量越大,体积越大;
(3)根据质量计算物质的量,根据n=c?V计算体积或浓度;
(4)根据氢气的体积结合化学方程式计算盐酸的物质的量,根据n=c?V计算体积.
点评:本题考查物质的量的有关计算,题目难度不大,注意有关物质的量的计算公式的运用.

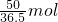 ;
;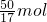 ;
;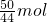 ;
;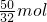 .
. =0.025mol,
=0.025mol, ,V=0.125L,即125ml,
,V=0.125L,即125ml,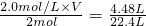


 高效智能课时作业系列答案
高效智能课时作业系列答案