
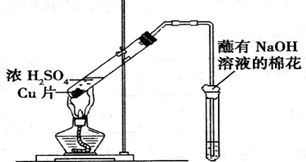
| 试管中试剂 | 试管中现象 | 解 释 | |
| A | 硝酸酸化的BaCl2溶液 | 生成白色沉淀 | 白色沉淀为BaSO3 |
| B | 品红溶液 | 溶液褪色 | SO2具有漂白性 |
| C | 紫色石蕊溶液 | 溶液变红 | SO2水溶液显酸性 |
| D | 酸性KMnO4溶液 | 紫色褪去 | SO2具有还原性 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.硝酸具有强氧化性,能将亚硫酸钠氧化为硫酸钠;
B.二氧化硫具有漂白性,能使品红溶液褪色;
C.二氧化硫能和水反应生成亚硫酸,亚硫酸电离出氢离子而使溶液呈酸性;
D.二氧化硫能被酸性高锰酸钾溶液氧化.
解答 解:A.硝酸具有强氧化性,能将亚硫酸钠氧化为硫酸钠,硫酸钠和氯化钡反应生成硫酸钡沉淀,所以得到的白色沉淀是硫酸钡,故A选;
B.二氧化硫具有漂白性,能和有色物质反应生成无色物质而使品红溶液褪色,该实验体现二氧化硫漂白性,故B不选;
C.二氧化硫能和水反应生成亚硫酸,亚硫酸电离出氢离子而使溶液呈酸性,酸遇石蕊试液变红色,故C不选;
D.二氧化硫能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,该实验体现二氧化硫还原性,故D不选;
故选A.
点评 本题考查化学实验方案评价,为高频考点,明确实验原理及物质性质是解本题关键,注意二氧化硫不能漂白酸碱指示剂,易错选项是A.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | X与Y能形成两种常见的气态化合物 | |
| B. | 原子半径的大小顺序:r(Z)>r(R)>r(X)>r(Y) | |
| C. | X、Z分别与R形成的化合物中化学键类型不同 | |
| D. | 含有Y、Z、R三种元素的化合物最多只有2种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:6 | B. | 2:15 | C. | 2:3 | D. | 16:25 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用磨口玻璃瓶、玻璃塞保存NaOH溶液 | |
| B. | 加入适量的金属钠除去酒精中少量的水 | |
| C. | 分液时,分液漏斗中的上层液体应由上口倒出 | |
| D. | 能使湿润的淀粉碘化钾试纸变蓝色的气体一定是Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 46g乙醇中含有共价键的数目为7NA | |
| B. | 50ml 2mol•L-1NaClO溶液中ClO-数目为0.1NA | |
| C. | 标准状况下,5.6gFe与足量的浓硫酸充分反应,转移电子数为0.2NA | |
| D. | 常温常压下,4.4g由CO2和N2O组成的混合气体所含原子总数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时,负极发生反应的物质是Li1-xCoO2 | |
| B. | 充电时,阴极发生氧化反应 | |
| C. | 放电时,Li+由负极向正极迁移 | |
| D. | 充电时,阳极的电极反应式为:xLi++nC+xe-=LixCn |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.现用该浓硫酸配制980mL 0.1mol/L的稀硫酸.可供选用的仪器有:
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.现用该浓硫酸配制980mL 0.1mol/L的稀硫酸.可供选用的仪器有:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A元素与C元素形成的分子不可能是非极性分子 | |
| B. | A、C、D元素分别与氢元素形成的最简单氢化物中,D的氢化物沸点最高 | |
| C. | A、B、C、D四种元素的基态原子中,B的原子半径最大 | |
| D. | A、B、C、D 四种元素对应单质的晶体都是分子晶体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com