
| A. | 室温时,0.1 mol•L-1某一元酸在水中有0.1%电离,此酸的电离平衡常数约为1×10-7 | |
| B. | 反应CO(g)+3H2(g)=CH4(g)+H2O(g)一定条件下可自发进行,则该反应的△H>0 | |
| C. | 可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀 | |
| D. | 为减小中和滴定误差,锥形瓶和滴定管必须洗净并润洗后才能使用 |
分析 A.HA电离出的c(H+)为0.1mol/L×0.1%=10-4mol/L,由HA?H++Ac-,c(H+)=c(Ac-)=10-4mol/L,据此计算平衡常数;
B.反应自发进行的判断依据是△H-T△S<0;
C.在电解池中,阳极金属易被腐蚀;
D.中和滴定过程中,锥形瓶不许用待测液清洗.
解答 解:A.HA电离出的c(H+)为0.1mol/L×0.1%=10-4mol/L,由HA?H++Ac-,c(H+)=c(Ac-)=10-4mol/L,则电离平衡常数为$\frac{1{0}^{-4}×1{0}^{-4}}{0.1}$=1×10-7,故A正确;
B.反应CO(g)+3H2(g)=CH4(g)+H2O(g)一定条件下可自发进行,△H-T△S<0,反应△S<0,则该反应的△H<0,故B错误;
C.地下输油钢管与外加直流电源的正极相连,在该电解池中,阳极金属铁易被腐蚀,故C错误;
D.中和滴定实验前,所使用的滴定管和锥形瓶必须洗净,滴定管用用待测液润洗,但是锥形瓶不能,否则滴定结果偏高,故D错误;
故选A.
点评 本题考查了弱电解质电离平衡计算、反应自发进行的判断依据、电化学金属防护、中和滴定法原理等知识点,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| Y | |||
| Z | W | X | |
| V |
| A. | Y的最简单氢化物的沸点比W的最简单氢化物的沸点高 | |
| B. | X元素含氧酸的酸性强于W元素含氧酸的酸性 | |
| C. | 根据在周期表中的位置,可用推测V具有半导体特性 | |
| D. | X的单质在水溶液中可置换出W |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
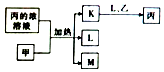 短周期主族元素W、X、Y、Z的原子序数依次增加,K、L、M均是由这些元素组成的二元化合物,甲、乙分别是元素X、Y的单质,甲是常见的固体,乙是常见的气体.K是无色气体,是主要的大气污染物之一,0.05mol/L丙溶液的pH为l,上述物质的转化关系如图所示.下列说法正确的是( )
短周期主族元素W、X、Y、Z的原子序数依次增加,K、L、M均是由这些元素组成的二元化合物,甲、乙分别是元素X、Y的单质,甲是常见的固体,乙是常见的气体.K是无色气体,是主要的大气污染物之一,0.05mol/L丙溶液的pH为l,上述物质的转化关系如图所示.下列说法正确的是( )| A. | 原子半径:W<X<Y | B. | 元素的非全属性:Z>Y>X | ||
| C. | 化合物XYZ中只含共价键 | D. | K、L、M中沸点最高的是M |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| NH3•H2O | 2×10-5 |
| HNO2 | 7×10-4 |
| HClO | 3×10-8 |
| H2CO3 | K1=4×10-7 K2=4×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1:1 | B. | 4:3 | C. | 3:1 | D. | 3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  蒸干CuCl2饱和溶液制备无水CuCl2 | |
| B. | 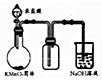 实验室制取并收集少量纯净氯气 | |
| C. | 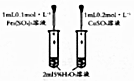 研究催化剂对H2O2分解速率的影响 | |
| D. | 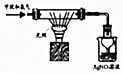 验证甲烷和氧气光照条件下发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由X与W形成的化合物是离子化合物 | |
| B. | Z元素的最低化合价为-1,最高化合价为+7 | |
| C. | Y的最高价氧化物对应水化物的酸性比U的强 | |
| D. | Z的简单离子半径小于U的简单阳离子半径 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com