
 如图装置中X和Y均为石墨电极,电解液为500mL某蓝色溶液,电解一段时间,观察到X电极表面开始没有气体产生,后来与Y电极产生的无色气体体积相同(标况);停止电解,取出X电极,洗涤、干燥、称量,电极增重1.6g;不考虑电解前后溶液体积变化.下列有关说法中不正确的是( )
如图装置中X和Y均为石墨电极,电解液为500mL某蓝色溶液,电解一段时间,观察到X电极表面开始没有气体产生,后来与Y电极产生的无色气体体积相同(标况);停止电解,取出X电极,洗涤、干燥、称量,电极增重1.6g;不考虑电解前后溶液体积变化.下列有关说法中不正确的是( )| A. | Y电极是阳极 | |
| B. | X电极产生气体标准状况下的体积为0.56L | |
| C. | 要使电解后溶液恢复到电解前的状态,需加入一定量的CuO或CuCO3 | |
| D. | 电解后溶液的pH=1 |
分析 A、根据溶液和析出金属的颜色可以知道电解的是铜盐溶液,在阳极Y上放出氧气,在阴极X上析出金属铜;
B、根据电极反应式结合电子守恒计算产生气体的体积;
C、根据电解质复原的原则:“出什么加什么”来回答;
D、根据电解后所得到的硫酸的量确定氢离子的量,并计算浓度得到溶液pH.
解答 解:根据溶液和析出金属的颜色可以知道电解的是铜盐溶液,在阳极Y上放出氧气,在阴极X上析出金属铜.
A、该电解池中,X电极表面有红色的固态物质生成,则X极是阴极,Y电极是阳极,故A正确;
B、电极X(阴极)的电极反应方程式是Cu2++2e-═Cu,阳极Y上4OH--4e-═O2↑+2H2O,当生成金属铜为1.6g时,即生成金属铜的物质的量是0.025mol,转移电子是0.05mol,此时生成氧气的物质的量是0.0125 mol,体积是0.0125mol×22.4L/mol=0.28L,故B错误;
C、电解过程中依据出什么加什么原则,电解过程中析出铜和氧气,所以要使电解后溶液恢复到电解前的状态加入氧化铜或碳酸铜可以恢复溶液浓度,故C正确;
D、电解硫酸铜溶液,电极X(阴极)的电极反应方程式是Cu2++2e-═Cu,阳极Y上4OH--4e-═O2↑+2H2O,当生成金属铜为1.6g时,即生成金属铜的物质的量是0.025mol,此时生成硫酸的物质的量是0.025mol,氢离子浓度是$\frac{0.025mol×2}{0.5L}$=0.1mol/L,溶液pH=1,故D正确.
故选B.
点评 本题考查学生电解池的工作原理以及应用知识,注意知识的归纳和整理是解题的关键,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有大量Fe3+的溶液:Na+、SCN-、Cl-、I- | |
| B. | 中性溶液:Fe3+、Al3+、NO${\;}_{3}^{-}$、SO${\;}_{4}^{2-}$ | |
| C. | 常温下,pH=12的溶液:Na+、K+、Cl-、SO${\;}_{4}^{2-}$ | |
| D. | 与铝粉反应放出H2的无色溶液:Br-、Al3+、Na+、SO${\;}_{4}^{2-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
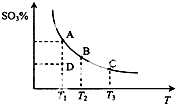 二氧化硫的催化氧化原理为2SO2(g)+O2(g)?2SO3(g),反应混合体系在平衡状态时SO3的百分含量与温度的关系如图所示.下列说法错误的是( )
二氧化硫的催化氧化原理为2SO2(g)+O2(g)?2SO3(g),反应混合体系在平衡状态时SO3的百分含量与温度的关系如图所示.下列说法错误的是( )| A. | 在D点时v正>v逆 | |
| B. | 其他条件不变,增大氧气的浓度可以提高二氧化硫的转化率 | |
| C. | 若B、C点的平衡常数分别为KB、KC,则KB>KC | |
| D. | 恒温恒容下向平衡体系中通入氦气,平衡向右移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
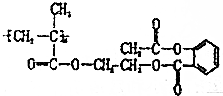 某药物的结构式如图所示,使其与含1.2g NaOH的溶液反应完全,消耗该药物的质量为( )
某药物的结构式如图所示,使其与含1.2g NaOH的溶液反应完全,消耗该药物的质量为( )| A. | 2.19n g | B. | 2.19g | C. | $\frac{2.92}{n}$g | D. | 2.92g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com