


 的相对分子质量大2,则符合下列条件的G的同分异构体有
的相对分子质量大2,则符合下列条件的G的同分异构体有 ,A与新制氢氧化铜悬浊液反应,醛基变为羧基,据F的结构简式可知,C3H6为丙烯,C为1,2-二溴丙烷,其水解生成D,D为1,2-二羟基丙醇,B与D在浓硫酸作用下发生酯化反应应,生成的E为
,A与新制氢氧化铜悬浊液反应,醛基变为羧基,据F的结构简式可知,C3H6为丙烯,C为1,2-二溴丙烷,其水解生成D,D为1,2-二羟基丙醇,B与D在浓硫酸作用下发生酯化反应应,生成的E为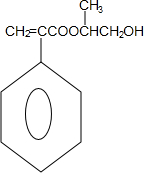 ,E发生加聚反应生成F,据此分析.
,E发生加聚反应生成F,据此分析. ,其所含官能团有碳碳双键和醛基;醛基变为羧基,据F的结构简式可知,C3H6为丙烯,其与溴放出加成反应生成的C为1,2-二溴丙烷,故答案为:碳碳双键、醛基;1,2-二溴丙烷;
,其所含官能团有碳碳双键和醛基;醛基变为羧基,据F的结构简式可知,C3H6为丙烯,其与溴放出加成反应生成的C为1,2-二溴丙烷,故答案为:碳碳双键、醛基;1,2-二溴丙烷; ,B中含有的官能团为羧基和碳碳双键,用碳酸氢钠溶液检验羧基,用溴水检验碳碳双键,故答案为:取代反应(或酯化反应);碳酸氢钠溶液(或碳酸钠)、溴水;
,B中含有的官能团为羧基和碳碳双键,用碳酸氢钠溶液检验羧基,用溴水检验碳碳双键,故答案为:取代反应(或酯化反应);碳酸氢钠溶液(或碳酸钠)、溴水; 的相对分子质量大2,为苯乙醇,其同分异构体具备①分子中含有苯环,且苯环上有两个取代基 ②遇氯化铁溶液变紫色
的相对分子质量大2,为苯乙醇,其同分异构体具备①分子中含有苯环,且苯环上有两个取代基 ②遇氯化铁溶液变紫色

 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:
| A、X的能量一定低于M的,Y的能量一定低于N的 |
| B、该反应一定要加热,反应才能进行 |
| C、破坏反应物中的化学键所吸收的能量小于形成生成物中的化学键所放出的能量 |
| D、X和Y的总能量低于M和N的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,28g C2H4含nA个碳碳双键 |
| B、1 mol Cu和足量稀硝酸反应生成nA NO分子 |
| C、常温常压下,22.4L CCl4含有nA个CCl4分子 |
| D、1mol/L NaCl溶液含有nA个Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 0.01mol?L-1KIO3酸性溶液的体积/mL | 0.01mol?L-1KI溶液的体积/mL | H2O的体积 /mL | 实验温度/℃ | 溶液出现蓝色时所需时间/s | |
| 实验1 | 5 | 5 | 5 | 25 | t1 |
| 实验2 | 4 | 5 | V1 | 25 | t2 |
| 实验3 | 5 | 5 | 5 | 35 | t3 |

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| X | Y | |
| Z | W |
| A、元素W位于第三周期第ⅦA族 |
| B、Y、Z都是植物必需的元素 |
| C、原子半径:W>Z>Y>X |
| D、X氧化物的大量排放导致化学烟雾 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| O3 |
| 反应Ⅰ |
| CO(NH2)2 |
| 反应Ⅱ |
| 催化剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com