
【题目】下列实验方案能达到实验目的的是(部分夹持装置已略去)
A. 验证木炭和浓硫酸反应生成CO2
验证木炭和浓硫酸反应生成CO2
B. 实验室制备Fe(OH)2并能较长时间观察到白色固体
实验室制备Fe(OH)2并能较长时间观察到白色固体
C.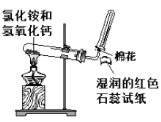 实验室制备和收集氨气并验满
实验室制备和收集氨气并验满
D.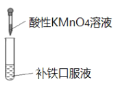 证明补铁口服液中存在+2价的铁
证明补铁口服液中存在+2价的铁
科目:高中化学 来源: 题型:
【题目】断裂1 mol化学键所需的能量如下:
化学键 | N—N | O=O | N≡N | N—H |
键能(kJ) | 154 | 500 | 942 | a |
火箭燃料肼(H2N—NH2)的有关化学反应的能量变化如图所示,则下列说法错误的是

A.N2比O2稳定
B.N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-534 kJ·mol-1
C.表中的a=194
D.图中的ΔH3=+2218 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A. 用惰性电极电解 Na2SO4溶液,当 2 mol 电子转移时,可加入 18 g 水恢复
B. 用惰性电极电解 CuSO4溶液,当加入 1 mol Cu(OH)2恢复电解前浓度时,电路中转移了 4 mol e-
C. 用惰性电极电解 1 mol CuSO4和 1 mol NaCl 的混合溶液,溶液的 pH 先减小后增大
D. 要想实现 Cu+H2SO4(稀) ═ CuSO4+H2↑的反应,需在电解池中进行,且 Cu 为阳极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究铁铜及其化合物的性质,某同学设计并进行了下列实验。下列说法错误的是
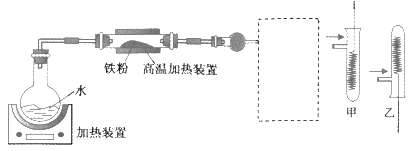
A. 高温加热装置中发生的反应为3Fe(s)+4H2O(g) ![]() Fe3O4(s)+4H2(g)
Fe3O4(s)+4H2(g)
B. 虚线框处宜选择的装置是甲
C. 实验时将螺旋状铜丝加热变黑后再趁热迅速伸入试管中,可观察到铜丝由黑色变为红色
D. 实验后,可用铝粉在高温下还原玻璃管中的固体获得铁单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科研人员提出HCHO(甲醛)与O2在羟基磷灰石(HAP)表面催化生成H2O的历程,该历程示意图如下(图中只画出了 HAP的部分结构):
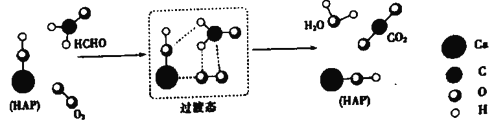
下列说法不正确的是
A. HAP能提高HCHO与O2的反应速率
B. HCHO在反应过程中,有C-H键发生断裂
C. 根据图示信息,CO2分子中的氧原子全部来自O2
D. 该反应可表示为:HCHO+O2![]() CO2+H2O
CO2+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮氧化合物和二氧化硫是引起雾霾的重要物质,工业用多种方法来治理。某种综合处理含NH4+废水和工业废气(主要含NO、CO、CO2、SO2、N2)的流程如图:
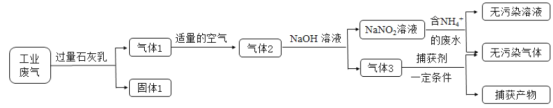
已知:NO+NO2+2NaOH=2NaNO2+H2O 2NO2+2NaOH=NaNO3+NaNO2+H2O
(1)固体1的主要成分有Ca(OH)2、__________(填化学式)。
(2)若实验室需要配制3 mol·L-1NaOH溶液1L进行模拟测试,需称取NaOH固体质量为__________g。
(3)用NaNO2溶液处理含NH4+废水反应的离子方程式为__________。
(4)验证废水中NH4+已基本除净的方法是___________(写出操作、现象与结论)。
(5)气体1转化为气体2时空气不能过量的原因是__________。
(6)捕获剂捕获的气体主要是__________(填化学式)。
(7)流程中生成的NaNO2因外观和食盐相似,又有咸味,容易使人误食中毒。已知NaNO2能发生如下反应:2NaNO2+4HI=2NO↑+I2+2NaI+2H2O;I2可以使淀粉变蓝。根据上述反应,选择生活中常见的物质和有关试剂进行实验,以鉴别NaNO2和NaCl。需选用的物质是__________(填序号)。
①水 ②淀粉碘化钾试纸 ③淀粉 ④白酒 ⑤白醋
A.①③⑤ B.①②④ C.①②⑤ D.①②③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计一个电池(如图所示),探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。
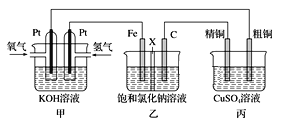
(1)通入氢气的电极为________ (填正极或负极),该电极反应式为________。
(2)石墨电极为________ (填阳极或阴极),乙中总反应离子方程式为________;如果把铁电极和石墨电极交换,乙溶液左侧出现的现象是__________________________________。
(3)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将__________(填“增大”“减小”或“不变”)。
(4)若甲中消耗0.01mol O2,丙中精铜增重_________克。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应对应的离子方程式正确的是
A.向Al2(SO4)3溶液中加入过量氨水:Al3++4OH-=![]() +2H2O
+2H2O
B.将Cl2通入FeCl2溶液中:Fe2++Cl2=Fe3++2Cl-
C.将钠投入硫酸铜溶液中:2Na+Cu2+ =Cu+ 2Na+
D.向小苏打溶液中加入少量Ca(OH)2 溶液:Ca2++2OH-+![]() =CaCO3↓+2H2O+
=CaCO3↓+2H2O+ ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是( )
A.升高温度,水的离子积增大
B.![]() 气体受压缩后,气体颜色先加深,后略变浅
气体受压缩后,气体颜色先加深,后略变浅
C.![]() ,
,![]() ,HIg的平衡体系,压缩容器体积,气体色变深
,HIg的平衡体系,压缩容器体积,气体色变深
D.![]() 中加入
中加入![]() 溶液,溶液颜色变浅
溶液,溶液颜色变浅
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com