
A��B��C�������ʵ�ת����ϵ��ͼ��ʾ�����ֲ�������ȥ����A�dz����Ľ������ʣ�ͨ��״����Y���������壬A��Y��ȼ�������ػ�ɫ�̣���Ӧ�١��ھ���ˮ��Һ�н��С�
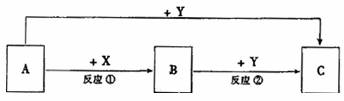
��ش�
��1��ʵ���ҿ���X��Ũ��Һ��ȡY����Ӧ�Ļ�ѧ����ʽΪ ������Ӧ��ת��0.05mol���ӣ�������Y������ڱ�״����Ϊ ����������X�����ʵ���Ϊ ��
��2����B��Һ�еμ�NaOH��Һ���ڿ����з���һ��ʱ�䣬�˹����е�ʵ������Ϊ �������漰����������ԭ��Ӧ����ʽΪ ��
��3��A�������X��Һ��Ӧ����B��ͬʱ����ij�����������Ϊ�˼�����Ӧ���ʶ���Ӱ������������������X��Һ�м��������� ��ѡ����ĸ��
a.CH3COONa���̣� b. CuSO4���̣� c.KNO3��Һ d.ˮ e.Na2SO4��Һ
��4��C��Һ����ᣨH2C2O4����Ӧ���õ�������Һ��ͬʱ����һ����ʹʯ��ˮ����ǵ����壬�˷�Ӧ�����ӷ���Ϊ ��
 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ||
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| 3 |
| 2 |
| 1 |
| 2 |
| 3 |
| 2 |
| 1 |
| 2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��֪A����ϩ��B��C��D��E��Ϊ�������л����һ�������£���������ͼ��ʾ��ת����ϵ����ش�
��֪A����ϩ��B��C��D��E��Ϊ�������л����һ�������£���������ͼ��ʾ��ת����ϵ����ش�| �� |
| �� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

| [��] |



 +n
+n
| һ������ |

 +n
+n
| һ������ |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��2013?��ɽһģ��������ͼ��a��b��c�������ʵ��ܽ�����ߣ��ش��������⣺
��2013?��ɽһģ��������ͼ��a��b��c�������ʵ��ܽ�����ߣ��ش��������⣺�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com