
已知化学反应2C(s)+O2(g)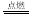 2CO(g);2CO(g) + O2(g)
2CO(g);2CO(g) + O2(g)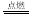 2CO2(g)都是放热反应。据此推断,下列说法不正确的是(相同条件下)( )
2CO2(g)都是放热反应。据此推断,下列说法不正确的是(相同条件下)( )
A.56gCO和32gO2所具有的总能量大于88gCO2所具有的总能量
B.12gC所具有的能量一定高于28gCO所具有的能量
C.12gC和32gO2所具有的总能量大于44gCO2所具有的总能量
D.将两份质量相等的碳燃烧,生成CO2的反应比生成CO的反应放出的热量多
 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案科目:高中化学 来源:2016-2017学年甘肃省高一上10月月考化学试卷(解析版) 题型:实验题
在除杂质的 实验操作中,为了将溶液中的杂质完全去除,通常需加入过量的除杂质试剂。某校化学课外活动小组为了除去粗盐中含有少量Na2SO4、MgCl2,设计了下列实验步骤:
实验操作中,为了将溶液中的杂质完全去除,通常需加入过量的除杂质试剂。某校化学课外活动小组为了除去粗盐中含有少量Na2SO4、MgCl2,设计了下列实验步骤:
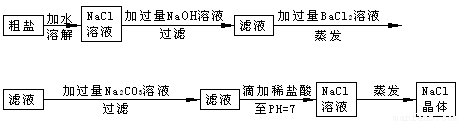
试简要说明
(1)加入过量BaCl2的溶液的原因____ ___ 。
(2)加 入过量Na2CO3的溶液的原因______ ___ _。
入过量Na2CO3的溶液的原因______ ___ _。
(3)滴加稀盐酸直至pH=7的目的是____ ___ _ _。
查看答案和解析>>
科目:高中化学 来源:2017届福建省四地六校高三上第一次月考化学试卷(解析版) 题型:推断题
[选做题——有机化学基础]
高分子材料PET聚酯树脂和PMMA的合成路线如下:
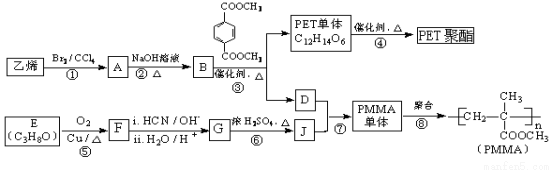
已知:
Ⅰ. RCOOR′+ R″18OH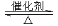 RCO18OR″+R′OH(R、R′、R″代表烃基)
RCO18OR″+R′OH(R、R′、R″代表烃基)
Ⅱ. 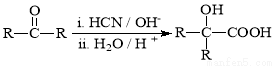 (R、R′代表烃基)
(R、R′代表烃基)
(1)G的官能团名称是___________、____________。
(2)②的化学方程式为 。
(3)⑥的反应类型是___________________________。
(4)J的某种同分异构体与J具有相同官能团,其结构简式是 。
(5)PMMA单体的结构简式为____________________。
(6)下列说法正确的是________(填字母序号)。
a.⑦为酯化反应
b.B和D互为同系物
c.D的沸点比同碳原子数的烷烃高
(7)F的核磁共振氢谱显示只有一组峰,⑤的化学方程式为_________________________。
查看答案和解析>>
科目:高中化学 来源:2017届福建省四地六校高三上第一次月考化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的数值,下列说法正确的是( )
A.7.8gNa2O2中含有的阴离子数是0.2 NA
B.常温常压下,8 g O2含有的电子数是4NA
C.标准状况下,2.24 L CCl4中含有的分子数为0.1NA
D.1 L 1.0 mol·L-1 Na2CO3溶液中含有的氧原子数为3NA
查看答案和解析>>
科目:高中化学 来源:2016-2017学年云南省曲靖市高二上第一次月考化学卷(解析版) 题型:填空题
CH4、H2、C都是优质的能源物质,它们燃烧的热化学方程式为:
①CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH= -890.3 kJ·mol-1
②2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1
③C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
(1)在深海中存在一种甲烷细菌,它们依靠酶使甲烷与O2作用而产生的能量存活,甲烷细菌使1 mol甲烷生成CO2气体与液态水,放出的能量____________(填“>”、“<”或“=”)890.3 kJ。
(2)甲烷与CO2可用于合成合成气(主要成分是一氧化碳和氢气):CH4+CO2= 2CO+2H2,1 g CH4完全反应可释放15.46 kJ的热量,则:

①上图(所有物质均为气态)能表示该反应过程中能量变化的是__________(填字母)。
②若将物质的量均为1 mol的CH4与CO2充入某恒容密闭容器中,体系放出的热量随时间的变化如图所示,则CH4的转化 率为 。
率为 。
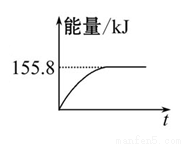
(3)C(s)与H2(g)不反应,所以C(s)+2H2(g)=CH4(g)的反应热无法直接测量,但通过上述反应可求出C(s)+2H2(g)=CH4(g)的反应热ΔH= 。
(4)目前对于上述三种物质的研究是燃料研究的重点,下列关于上述三种物质的研究方向中可行的是_____________(填字母)。
A.寻找优质催化剂,使CO2与H2O反应生成CH4与O2,并放出热量
B.将固态碳合成为C60,以C60作为燃料
C.寻找优质催化剂,利用太阳能使大气中的CO2与海底开采的CH4合成合成气(CO、H2)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二上10月月考化学试卷(解析版) 题型:填空题
甲小组以H2O2分解为例,探究外界条件对反应速率的影响。在常温下按照下表所示的方案完成实验。
实验编号 | 反应物 | 催化剂 |
① | 10 mL 2% H2O2溶液 | 无 |
② | 10 mL 5% H2O2溶液 | 无 |
③ | 10 mL 5% H2O2溶液 | 1 mL 0.1 mol·L-1 FeCl3溶液 |
(1)实验①和②的目的是 。进行实验时没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进方法是 (填一种即可)。
(2)利用实验②和③可知加入FeCl3溶液可以催化H2O2分解,已知FeCl3溶液中含有H2O、Fe3+和Cl-三种粒子,为探究哪种粒子具有催化作用,有如下三种猜想:
猜想1:真正催化分解H2O2的是FeCl3溶液中的H2O
猜想2:真正催化分解H2O2的是FeCl3溶液中的Fe3+
猜想3:真正催化分解H2O2的是FeCl3溶液中的Cl-
你认为最不可能的是猜想 ;理由是 。
(3)同学们又对余下的两种猜想进行了实验探究,请你帮助他们填写下表:
实验步骤 | 实验现象 | 实验结论 |
向盛有5 mL 15%的H2O2溶液的试管中加入少量的HCl,然后把带火星的木条伸入试管中。 | 无明显现象 | ① |
向盛有5 mL 15%的H2O2溶液的试管中加入少量的FeCl3固体,然后把带火星的木条伸入试管中。 | ② | ③ |
乙小组通过Na2S2O3与0.1 mol·L-1 H2SO4反应溶液浑浊的时间,研究外界条件对化学反应速率的影响。设计实验如下:
实验编号 | 温度/℃ | Na2S2O3 | V(H2SO4)/mL | V(H2O)/mL | |
c/mol·L-1 | V/mL | ||||
① | 25 | 0.1 | 5.0 | 10.0 | a |
② | 25 | 0.1 | 10.0 | 10.0 | 0 |
③ | 25 | 0.1 | 5.0 | 5.0 | b |
(4)已知:反应中除生成淡黄色沉淀外还会生成刺激性气味的气体,写出反应离子方程式: ;
(5)若同时选择实验①②、实验①③,测定混合液变浑浊的时间,可分别探究Na2S2O3浓度和H2SO4的浓度对化学反应速率的影响,则表中b为 mL。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二上10月月考化学试卷(解析版) 题型:选择题
在1.0 L密闭容器中放入0.10 mol X,在一定温度下发生反应:X(g) Y(g)+Z(g) ?H<0容器内气体总压强p随反应时间t的变化关系如下图所示。以下分析正确的是
Y(g)+Z(g) ?H<0容器内气体总压强p随反应时间t的变化关系如下图所示。以下分析正确的是

A.从反应开始到t1时的平均反应速率
v(X)= mol/(L·min)
mol/(L·min)
B.该温度下此反应的平衡常数K=0.32
C.欲提高平衡体系中Y的含量,可升高体系温度或减少Z的量
D.其他条件不变,再充入0.1 mol 气体X,平衡正向移动,X的转化率增大
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二上10月月考化学试卷(解析版) 题型:选择题
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:

①CH3OH(g)+H2O(g)===CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
②CH3OH(g)+ O2(g)===CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
O2(g)===CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
下列说法正确的是
A.CH3OH的燃烧热为-192.9 kJ·mol-1
B.反应①中的能量变化如图所示
C.CH3OH转变成H2的过程一定要吸收能量
D.由②推知反应CH3OH(l)+ O2(g)===CO2(g)+2H2(g)ΔH >-192.9 kJ·mol-1
O2(g)===CO2(g)+2H2(g)ΔH >-192.9 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省高二上第一次大考化学卷(解析版) 题型:选择题
反应A+3B 2C+2D,在四种不同情况下的反应速率分别为:①v(A)=0.15 mol·L-1·s-1;②v(B)=0.6 mol·L-1·s-1;③v(C)=0.4 mol·L-1·s-1;④v(D)=0.45 mol·L-1·s-1。该反应进行的最快的是( )
2C+2D,在四种不同情况下的反应速率分别为:①v(A)=0.15 mol·L-1·s-1;②v(B)=0.6 mol·L-1·s-1;③v(C)=0.4 mol·L-1·s-1;④v(D)=0.45 mol·L-1·s-1。该反应进行的最快的是( )
A.① B.④ C.①④ D.②③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com