
| A、反应物总能量低于生成物总能量时,该反应不能发生 |
| B、氢气燃烧热的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l)△H=-285.8kJ/mol |
| C、甲烷是清洁、无污染的化石燃料 |
| D、氢气是热值高、无污染的燃料 |


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
| A、金属腐蚀就是金属失去电子被还原的过程 |
| B、将水库中的水闸(钢板)与外加直接电源的负极相连,正极连接到一块废铁上可防止水闸被腐蚀 |
| C、由原电池原理知所有的合金都比纯金属更易被腐蚀 |
| D、铜板上的铁铆钉处在潮湿的空气中发生:Fe-3e-═Fe3+,从而形成铁锈,但此过程铜不被腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )
短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )| A、最简单气态氢化物的热稳定性:R>Q |
| B、最高价氧化物对应水化物的酸性:Q>W |
| C、原子半径:T>Q>R |
| D、Q最高价氧化物形成的晶体熔点很低 |
查看答案和解析>>
科目:高中化学 来源: 题型:
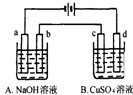 按如图装置进行电解(均是惰性电极),已知A烧杯中装有500mL20%的NaOH溶液,B烧杯中装有500mL pH为6的1mol?L-1CuSO4溶液.通电一段时间后,在b电极上收集到28mL气体(标准状况),则B烧杯中溶液pH变为(溶液体积变化忽略不计)( )
按如图装置进行电解(均是惰性电极),已知A烧杯中装有500mL20%的NaOH溶液,B烧杯中装有500mL pH为6的1mol?L-1CuSO4溶液.通电一段时间后,在b电极上收集到28mL气体(标准状况),则B烧杯中溶液pH变为(溶液体积变化忽略不计)( )| A、4 | B、3 | C、2 | D、1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若配制100mL 0.5mol/L Na2SO4溶液,则需要称量Na2SO4?10H2O的质量为7.1g |
| B、80g NaOH溶于1L水中,则溶质的物质的量浓度为2mol/L |
| C、1mol氢气和1mol氦气中,所含的分子数相同、原子数相同、质量也相同 |
| D、1mol Al与足量的稀盐酸反应,失去的电子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
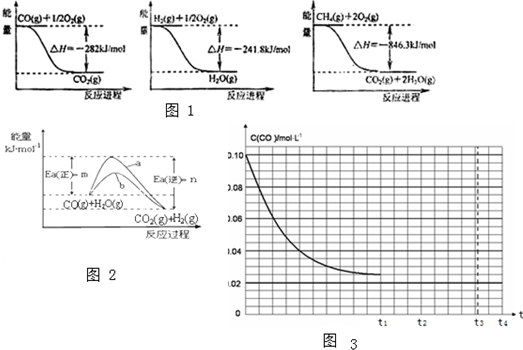
| 温度 | 400 | 500 | 800 |
| 平衡常数 | 9.94 | 9 | 1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com