
【题目】
①配制一定物质的量浓度的溶液 ②PH试纸的使用 ③过滤 ④蒸发
A. 试管 B. 胶头滴管 C. 玻璃棒 D. 漏斗
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】【化学——选修3:物质结构与性质】某配位化合物为深蓝色晶体,由原子序数依次增大的A、B、C、D、E五种元素组成,其原子个数比为l4︰4︰5︰1︰1。其中C、D元素同主族且原子序数D为C的二倍,E元素的外围电子排布为(n-1)d n+6nsl。回答下列问题。
(1)元素D在周期表中的位置是 ,B原子的外围电子排布图为 。E原子的核外有 种不同运动状态的电子,B和C的第一电离能大小关系是 。(用元素符号表示)
(2)C元素可与A元素形成两种常见的化合物,其原子个数比分别为1︰1和l︰2,写出原子个数比为1︰1的化合物的电子式 ,两种化合物可以任意比互溶,解释其主要原因为 。
(3)该配位化合物的化学式为 。
(4)A元素与B元素可形成分子式为A2B2的化合物,该化合物的分子具有平面结构,则其结构式为 ,用电子式表示化合物Na2D的形成过程 。
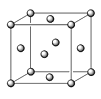
(5)已知E的晶胞结构如图所示,此晶胞立方体的边长为a cm,E单质的密度为ρ g·cm-3,则阿伏伽德罗常数为 (用a、ρ表示)。该晶胞配位数为 ,EDC4常作电镀液,其中DC42-的空间构型是 ,其中D原子的杂化轨道类型是 。若电解EDC4的水溶液,则电解总反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2A(g)+B(g)=3C(g)+4D(g)反应中,表示该反应速率最快的数据是
A.v(A)=0.9 mol /(L·s) B.v(B)=0.5 mol/(L·s)
C.v(C)=1.4 mol /(L·s) D.v(D)=1.8 mol /(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2A(g)+B(g)![]() 3C(g)+4D(g)反应中,表示该反应速率最快的是 ( )
3C(g)+4D(g)反应中,表示该反应速率最快的是 ( )
A.υ(A)= 0.5 mol/(L·s) B.υ(B)= 0.3 mol/(L·s)
C.υ(C)= 0.8 mol/(L·s) D.υ(D)= 1 mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是一种重要的工业原料。
(1)写出实验室制取氯气反应的化学方程式________________________。
(2)资料显示:Ca(ClO)2 +CaCl2+2H2SO4![]() 2CaSO4+2Cl2↑+2H2O。某学习小组利用此原理设计如图所示装置制取氯气并探究其性质。
2CaSO4+2Cl2↑+2H2O。某学习小组利用此原理设计如图所示装置制取氯气并探究其性质。

①在该实验中,甲部分的装置是_______(填字母)。
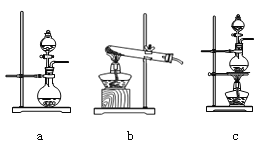
②乙装置中FeCl2溶液与Cl2反应的离子方程式是________________。
③丙装置中通入少量Cl2,可制得某种生活中常用的漂白、消毒的物质,这种物质是_______(化学式)。
④有人认为该实验存在明显的缺陷,请你将认为缺少的部分在上图中的相应位置画出,并在添加的装置中标明需要放入的最合适的化学试剂。______________
请你写出Cl2和“④”中“最合适的化学试剂”反应的离子方程式______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究CO、NOx、SO2等的处理方法对环境保护有重要意义。
(1)科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,其反应为:2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) △H=-746.8kJ·mol-1
2CO2(g)+N2(g) △H=-746.8kJ·mol-1
①为了研究外界条件对该反应的影响,进行下表三组实验,测得不同时刻NO的浓度(c)随时间变化的趋势如图1所示。1、2、3代表的实验编号依次是___________。(已知在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。)
实验 编号 | 温度 (℃) | NO初始浓度(mol·L-1) | CO初始浓度 (mol·L-1) | 催化剂比表面积(m2·g-1) | 催化剂用量(g) |
Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 | 50 |
Ⅱ | 280 | 1.20×10-3 | 5.80×10-3 | 124 | 50 |
Ⅲ | 350 | 1.20×10-3 | 5.80×10-3 | 124 | 50 |
②图2表示NO的平衡转化率(α)随温度、压强变化的示意图。X表示的是__________,理由是________;Y表示的是________,且Y1________Y2(填“>”或“<”)。

(2)一定温度下,将NO2与SO2以体积比1:2置于密闭容器中发生反应NO2(g)+SO2(g)![]() SO3(g)+NO(g),达到平衡时SO3的体积分数为25%。该反应的平衡常数K=_______。
SO3(g)+NO(g),达到平衡时SO3的体积分数为25%。该反应的平衡常数K=_______。
(3)利用原电池反应可实现NO2的无害化,总反应为6NO2+8NH3![]() 7N2+12H2O,电解质溶液为碱性。工作一段时间后,该电池负极区附近溶液pH________(填“变大”、“变小”或“不变”),正极电极反应式为_______。
7N2+12H2O,电解质溶液为碱性。工作一段时间后,该电池负极区附近溶液pH________(填“变大”、“变小”或“不变”),正极电极反应式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)将质量比为7∶15的N2和NO混合,则混合气体中N2和NO的物质的量之比为______;氮原子和氧原子的个数之比为_______ ;22克该混合气体在标准状况下的体积为_________。
(2)在氯化镁和硫酸镁的混合液中,若Mg2+与Cl-的物质的量浓度之比为4∶3时,则.Mg2+与SO![]() 物质的量浓度之比为______。
物质的量浓度之比为______。
(3)将8g铁片放入100mL硫酸铜溶液中,溶液中的Cu2+全部被还原时,“铁片”变为8.4g,则原c(CuSO4)为___________mol/L 。
(4)使4.48 L CO2气体迅速通过Na2O2固体后得到3.36 L(标准状况下)气体,这3.36 L气体的质量是 _________ g 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com