
| A. | Zn(l)=Zn(g)△H=$\frac{1}{2}$(△H1-△H2 ) | |
| B. | 用硅制作的太阳能电池是将化学能转化为电能 | |
| C. | 增加Zn(g)的量,△H2变大 | |
| D. | 以Zn片、铜片和稀硫酸构成的原电池,Zn片表面有气泡产生. |
分析 A、根据盖斯定律来分析;
B、太阳能电池是将光能转化为电能;
C、△H2是2molZn(g)反应对应的反应热,与Zn(g)的用量无关;
D、在铜锌原电池中,锌做负极,锌本身放电.
解答 解:A、已知:①SiCl4(g)+2Zn(l)?Si(s)+2ZnCl2(g)△H1
②SiCl4(g)+2Zn(g)?Si(s)+2ZnCl2(g)△H2.根据盖斯定律,将(①-②)×$\frac{1}{2}$即可得Zn(l)=Zn(g)△H=$\frac{1}{2}$(△H1-△H2 ),故A正确;
B、用硅制作的太阳能电池是将太阳能转化为电能,故B错误;
C、△H2是2molZn(g)反应对应的反应热,与Zn(g)的用量无关,故增加Zn(g)的量,反应吸收或放出的热量增多,但△H2不变,故C错误;
D、以Zn片、铜片和稀硫酸构成的原电池,负极上锌本身放电,负极变细,正极铜片表面有气泡产生,故D错误.
故选A.
点评 本题考查了利用盖斯定律来书写热化学方程式、反应热△H的含义以及原电池正负极反应等,难度不大.应注意的是△H2是2molZn(g)反应对应的反应热,与Zn(g)的用量无关.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:多选题
| 编号 | 实验 | 结论 |
| A | 向某溶液中加入稀盐酸,将产生的气体通入澄清石灰水,石灰水变浑浊 | 该溶液一定是碳酸盐溶液 |
| B | 用铂丝蘸取少量某溶液在酒精灯火焰上进行焰色反应,火焰呈黄色 | 该溶液不一定是钠盐溶液 |
| C | 往淀粉溶液中加稀硫酸,加热片刻,滴加银氨溶液并水浴加热,无银镜出现 | 该淀粉未发生水解 |
| D | 向某溶液中滴加KSCN 溶液,溶液不变色,滴加氯水后溶液显红色 | 该溶液中一定含Fe2+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
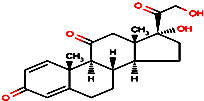 2014年广东省发现登革热病例.登革热是由登革热病毒引起的一种急性发热性疾病,其特征为发热、关节痛、肌肉痛、皮疹、淋巴结肿大和白细胞减少.对高热不退及毒血症状严重者,可短期应用小剂量肾上腺皮质激素,如口服泼尼松.泼尼松的结构简式如图所示,下列有关它的说法正确的是( )
2014年广东省发现登革热病例.登革热是由登革热病毒引起的一种急性发热性疾病,其特征为发热、关节痛、肌肉痛、皮疹、淋巴结肿大和白细胞减少.对高热不退及毒血症状严重者,可短期应用小剂量肾上腺皮质激素,如口服泼尼松.泼尼松的结构简式如图所示,下列有关它的说法正确的是( )| A. | 分子式为C21H22O5 | |
| B. | 属于芳香族化合物 | |
| C. | 1mol该物质最多能与5molH2发生加成反应 | |
| D. | 该物质能发生加成、取代、氧化、水解等反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8+$\frac{1}{2}$ lg2 | B. | 9+lg2 | C. | 10+$\frac{1}{2}$ lg2 | D. | 11+2lg2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| | | G | | X |
| R | T | Y |
| A. | R和Y组成的化合物水溶液呈中性 | |
| B. | 最高价氧化物的水化物酸性:Y>G>X>R | |
| C. | 简单氢化物稳定性:X>Y>T | |
| D. | 常温下,TX4、TY4都呈液态 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 金属氢氧化物 | 开始沉淀pH | 完全沉淀的pH |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.7 |
| Cu(OH)2 | 4.6 | 6.4 |
| Zn(OH)2 | 5.9 | 8.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(C)=0.5mol/(L•min) | B. | x=3 | ||
| C. | B的转化率为25% | D. | 平衡时C的体积分数为28.6% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y |
| Z | W |
| A. | 若HmXOn为强酸,则Y的氢化物溶于水显酸性(m、n均为正整数) | |
| B. | 若W(OH)n为两性氢氧化物,则Z(OH)m为强碱(m、n均为正整数) | |
| C. | 若气体XHn不溶于水,则HmWOn为强酸(m、n、a均为正整数) | |
| D. | 若HmZOn为强酸,则气体HnY易溶于水(m、n、a均为正整数) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com