���㣺�������ǵ����,��ѧ����ʽ����д,���뷽��ʽ����д,������ԭ��Ӧ�ļ���
ר�⣺������ԭ��Ӧר��,���ӷ�Ӧר��
����������ʣ���ˮ��Һ�л�����״̬���ܹ�����Ļ�����ǵ���ʣ�������״̬��ˮ��Һ�ж����ܵ���Ļ����
II����1����������ǿ�������ȫ����������������Ӻ������ӣ���2����Һ�����ԣ����ݵ���غ���⣻
��1��ͭ��������ȼ�������Ȼ�ͭ��
��2���ƺ�ˮ��Ӧ�����������ƺ�������
��3��Ư�ۺͿ����ж�����̼��ˮ��Ӧ���ɴ������̼��ƣ�
������1��8NH
3+3Cl
2=6NH
4Cl+N
2����Ԫ�ػ��ϼ����ߣ�����������Ӧ����Ԫ�ػ��ϼ۽��ͷ�����ԭ��Ӧ���÷�Ӧ����1mol����ת��6mol���ӣ��ݴ˽��
��2���÷�Ӧ�У������е���Ԫ�ػ��ϼ�ȫ�����ͣ������еĵ�Ԫ��ֻ��
���ϼ����ߣ��ݴ˽��
��3�����ݵ�ʧ�����غ��ԭ����˫���ŷ��������ת�Ƶķ�������Ŀ��
��������n=
��������������ļ��㣬����COΪxmol��CO
2Ϊymol���з���ʽ���㣮
���
�⣺��FeΪ�������ʣ��Ȳ��ǵ����Ҳ���Ƿǵ���ʣ�
��CO
2�������ܵ��룬�Ƿǵ���ʣ�
��Na
2O������״̬���ܹ����磬�ǵ���ʣ�
��Cu��OH��
2��ˮ��Һ���ܹ����磬�ǵ���ʣ�
��MgCl
2��ˮ��Һ�л�����״̬���ܹ����磬�ǵ���ʣ�
��NH
4Cl��Һ�ǻ����Ȳ��ǵ����Ҳ���Ƿǵ���ʣ�
��H
2SO
4��ˮ��Һ���ܹ����磬�ǵ���ʣ�
��C
2H
5OH���ƾ���������״̬��ˮ��Һ�ж����ܵ��磬�Ƿǵ���ʣ�
�����ڵ���ʵ��Ǣۢܢݢߣ����ڷǵ���ʵ��Ǣڢ࣬
�ʴ�Ϊ���ۢܢݢߣ��ڢࣻ
II����1����������ǿ�������ȫ���룬���뷽��ʽ��Al
2��SO
4��
3=2Al
3++3SO
42-��
�ʴ�Ϊ��Al
2��SO
4��
3=2Al
3++3SO
42-��
��2����Һ�����ԣ����ݵ���غ��й�ϵʽ��C��Al
3+����3+C��K
+��=2��C��SO
42-��������������Ũ�ȴ���ã�C��Al
3+����3+0.2mol?L
-1=2��0.7mol?L
-1��
C��Al
3+��=0.4mol/L��
�ʴ�Ϊ��0.4��
��1��ͭ�������о���ȼ�������ػ�ɫ���Ȼ�ͭ����Ӧ����ʽΪ��Cu+Cl
2CuCl
2���ʴ�Ϊ��Cu+Cl
2CuCl
2������ȼ�գ����ػ�ɫ�̣�
��2���ƺ�ˮ��Ӧ�����������ƺ���������Ӧ�ķ���ʽΪ��2Na+2H
2O=2NaOH+H
2�����ʴ�Ϊ��2Na+2H
2O=2NaOH+H
2����
��3��Ư�ۺͿ����ж�����̼��ˮ��Ӧ���ɴ������̼��ƣ���ӦΪCa��ClO��
2+CO
2+H
2O=CaCO
3��+2HClO���ʴ�Ϊ��Ca��ClO��
2+CO
2+H
2O=CaCO
3��+2HClO��
������1���÷�Ӧ�����е������е���Ԫ�ػ��ϼ۽��ͣ���������������������Ԫ�ػ��ϼ����ߣ���������
�ʴ�Ϊ��Cl
2��������N��
��2���ڷ�Ӧ8NH
3+3Cl
2=6NH
4Cl+N
2��3mol�����е���Ԫ�ػ��ϼ۶����ͣ�����3mol����������������8mol������ֻ��2mol�����еĵ�Ԫ�ػ��ϼ����ߣ���������ԭ���İ���ֻ��2mol�������������ͻ�ԭ�����ʵ���֮����3��2��
�ʴ�Ϊ��3��2��
��3�����ݵ�ʧ�����غ��ԭ����˫���ŷ��������ת�Ƶķ�������Ŀ��

��
�ʴ�Ϊ��

��
������COΪxmol��CO
2Ϊymol��
��
��֮�ã�
��
���������CO��CO
2�����ʵ����ֱ���0.3mol��0.15mol��
�ʴ�Ϊ��0.15mol��0.3mol��
���������⿼���˵���ʺͷǵ���ʵ��жϣ����ʵ��������ʵ���Ũ�ȵ���ؼ��㣬��Ӧ����ʽ����д��������ԭ��Ӧ�ĸ���ͱ�ʾ��������Ŀ�Ƚϼ�ע����еģ�2�����״��

 ��
�� ��
��


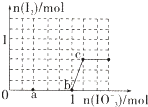 ��֪��3molNaHSO3����Һ����μ���KIO3��Һ�������KIO3��������I2�����ʵ����Ĺ�ϵ������ͼ��ʾ���������жϲ���ȷ���ǣ�������
��֪��3molNaHSO3����Һ����μ���KIO3��Һ�������KIO3��������I2�����ʵ����Ĺ�ϵ������ͼ��ʾ���������жϲ���ȷ���ǣ�������