

分析 (1)①砷元素有+2、+3+5等常见价态,雄黄As2S3和雌黄As4S4都是硫元素化合价-2价;依据转化关系分析可知,雌黄(As2S3)酸性溶液中和Sn2+离子发生氧化还原反应生成As4S4、H2S、Sn4+,结合电荷守恒、原子守恒配平书写离子方程式;
②雄黄在空气中加热至300℃时会产生两种物质,其中一种氧化物为剧毒的砒霜(As2O3),若4.28g As4S4反应转移0.28mole-,据此计算a中硫的化合价;过氧化氢中氢元素化合价-1价变化为-2价,As元素化合价+3价变化为+5价,结合电子守恒和原子守恒写出该反应的化学方程式;
(2)根据0.4mol AsH3气体在空气中自燃,氧化产物为As2O3固体,放出b kJ热量,则2mol AsH3气体在空气中自燃,氧化产物为As2O3固体,放出5b kJ热量,据此书写AsH3自燃的热化学方程式;
(3)①可逆反应达到平衡状态即电流强度为0;
②由a点对应图2中电流由C1极经外电路流向C2极,则d点电流方向与a点相反即电流由C2极经外电路流向C1极,则负极C1极失电子发生氧化反应;
③由a点对应图2中电流由C1极经外电路流向C2极,则电池总反应为Na2HAsO4(aq)+NaI (aq)=Na3AsO3(aq)+I2(aq)+H2O(l),图3中,b→c电流方向改变,则电池总反应为Na3AsO3(aq)+I2(aq)+H2O(l)?Na2HAsO4(aq)+NaI (aq),即平衡向正反应方向移动,据此分析改变条件;
c→d电流强度减小,说明随着正反应进行,反应浓度下降,反应速率下降,单位时间转移的电子(电量)减少.
解答 解:(1)①砷元素有+2、+3+5等常见价态,砷元素化合价+3、+2价,则雌黄和雄黄中S元素的价态相同,其价态是-2价,依据转化关系分析可知,雌黄(As2S3)酸性溶液中和Sn2+离子发生氧化还原反应生成As4S4、H2S、Sn4+,结合电荷守恒、原子守恒配平书写离子方程式为:2As2S3+4H++2Sn2+=As4S4+2H2S+2Sn4+,故答案为:-2;4H++2Sn2++2As2S3=2H2S↑+2Sn4++As4S4;
②雄黄在空气中加热至300℃时会产生两种物质,其中一种氧化物为剧毒的砒霜(As2O3),若4.28g As4S4反应转移0.28mole-,则设反应后生成a中硫的化合价为+x,则$\frac{4.28g}{428g/mol}$×(4+2+x)=0.28mol,解得x=+4,所以a为二氧化硫,双氧水将As2O3氧化为H3AsO4而除去,氧化还原反应中过氧化氢中氢元素化合价-1价变化为-2价,As元素化合价+3价变化为+5价,结合电子守恒和原子守恒写出该反应的化学方程式为2H2O2+H2O+As2O3=2H3AsO4,
故答案为:SO2;2H2O2+H2O+As2O3=2H3AsO4;
(2)由0.4mol AsH3气体在空气中自燃,氧化产物为As2O3固体,放出b kJ热量,则2mol AsH3气体在空气中自燃,氧化产物为As2O3固体,放出5b kJ热量,则AsH3自燃的热化学方程式为2AsH3(g)+3O2(g)=As2O3(s)+3H2O(l)△H=-5bKJ/mol;故答案为:2AsH3(g)+3O2(g)=As2O3(s)+3H2O(l)△H=-5bKJ/mol;
(3)①可逆反应达到平衡状态即电流强度为0,则由图象可知表示在该时刻上述可逆反应达到平衡状态的点是b;故答案为:b;
②由a点对应图2中电流由C1极经外电路流向C2极,则d点电流方向与a点相反即电流由C2极经外电路流向C1极,则负极C1极失电子发生氧化反应,反应式为AsO32--2e-+H2O=HAsO42-+H+;故答案为:AsO32--2e-+H2O=HAsO42-+H+;
③由a点对应图2中电流由C1极经外电路流向C2极,则电池总反应为Na2HAsO4(aq)+NaI (aq)=Na3AsO3(aq)+I2(aq)+H2O(l),图3中,b→c电流方向改变,则电池总反应为Na3AsO3(aq)+I2(aq)+H2O(l)?Na2HAsO4(aq)+NaI (aq),即平衡向正反应方向移动,
A.向左室中加入适量的浓Na3AsO3溶液,平衡向正反应方向移动,故A正确;
B.向左室中加入适量的烧碱溶液,消耗Na2HAsO4(aq),平衡向正反应方向移动,故B正确;
C.向右室中加入适量的浓KI溶液,平衡向逆反应方向移动,故C错误;
D.向右室中加入适量的稀硫酸,平衡向逆反应方向移动,故D错误;
c→d电流强度减小,说明随着正反应进行,反应浓度下降,反应速率下降,单位时间转移的电子(电量)减少;
故答案为:AB;停止改变条件,随着正反应进行,反应浓度下降,反应速率下降,单位时间转移的电子(电量)减少.
点评 本题考查了元素化合物的性质的综合应用、热化学方程式的书写、离子方程式的书写、电解原理应用等,题目难度中等,侧重于基础知识的综合应用能力的考查,注意把握题目中的信息以及对图象的分析理解.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 用氨水溶解氯化银沉淀:Ag++2NH3•H2O=[Ag(NH3)2]++2H2O | |
| B. | Mg(HCO3)2溶液中加入足量NaOH溶液:Mg2++2HCO3-+2OH-═Mg CO3↓+CO32-+2H2O | |
| C. | Na2O2固体投入H218O中:2H218O+2Na2O2=4Na++4OH-+18O2↑ | |
| D. | 苯酚钠溶液跟AlCl3溶液反应:3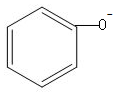 +Al3++3H2O→ +Al3++3H2O→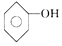 +Al(OH)3↓ +Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ②③④ | C. | ②④⑤ | D. | ①④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 碳元素不仅能形成丰富多彩的有机化合物,而且还能形成多种无机化合物,同时自身可以形成多种单质,碳及其化合物的用途广泛.
碳元素不仅能形成丰富多彩的有机化合物,而且还能形成多种无机化合物,同时自身可以形成多种单质,碳及其化合物的用途广泛.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol Cu与足量的浓硫酸完全反应后,溶液中Cu2+数目为0.1NA | |
| B. | 标准状况下,11 g由3H和16O组成的超重水中,电子数和中子数均为5NA | |
| C. | 标准状况下,将3.36L Cl2通入1 L0.2 mol•L-1的FeBr2溶液中,被氧化的Br-数目为0.1NA | |
| D. | 等物质的量过氧化钠和氧化纳固体中所含阴离子数均为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10g46%的乙醇水溶液中所含氢原子的数目为0.6NA | |
| B. | 0.1mol•L-1AlCl3溶液中含有Cl-数目为0.3NA | |
| C. | 5.6g乙烯和环丁烷(C4H8)的混合气体中含的碳原子数为0.4 NA | |
| D. | 11.2LCO2与足量的Na2O2充分反应,转移的电子数为0.5NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com