【答案】
分析:(1)根据c=
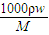
来计算浓度,利用浓硫酸具有腐蚀性的性质来分析应贴的图标,利用配制溶液时溶质的物质的量相等来列式计算;
(2)若产生相同质量的沉淀,则氯离子的物质的量相同,利用n=cV来分析;
(3)n=

=
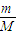
,并结合物质的构成来分析原子的物质的量,原子的物质的量越多,则原子个数越多;
(4)利用2Na+2H
2O═2NaOH+H
2↑、2Al+2NaOH+2H
2O═2NaAlO
2+3H
2↑、Na
2O+H
2O═2NaOH来计算.
解答:解:(1)98%的浓H
2SO
4(ρ=1.84g/cm
3),则其物质的量浓度为c=
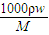
=
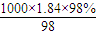
=18.4 mol?L
-1,
浓硫酸是液体,不燃烧,也不是剧毒物质,但具有强烈的腐蚀性,则应贴的图标为A,
配制500m L 0.2mol?L
?1的稀硫酸,设需要的浓硫酸的体积为V,
根据配制前后溶质的物质的量相当,则0.5L×0.2mol/L=V×18.4 mol?L
-1,
解得V=0.0054L=5.4 ml,
故答案为:18.4 mol?L
-1;A;5.4ml;
(2)因产生相同质量的沉淀,则氯离子的物质的量相同,设NaCl、MgCl
2、AlCl
3溶液的体积分别为x、y、z,
溶液的浓度都是c,则x×c×1=y×c×2=z×c×3,
解得x:y:z=6:3:2,故答案为:6:3:2;
(3)①0.5molNH
3中原子的总物质的量为0.5mol×4=2mol,
②标准状况下22.4LHe中原子的物质的量为
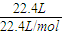
×1=1mol,
③4℃时9mLH
2O的质量为9mL×1g/mL=9g,其物质的量为
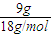
=0.5mol,
则原子的总物质的量为0.5mol×3=1.5mol,
④0.2molH
3PO
4中原子的总物质的量为0.2mol×8=1.6mol,
显然原子的物质的量由多到少的顺序为①④③②,
原子个数由多到少的顺序为①④③②,故答案为:①④③②;
(4)铝箔质量比反应前减少了0.27g,参加反应的Al的质量为
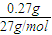
=0.01mol,
在容器中收集到1.12L氢气(标准状况),氢气的物质的量为
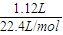
=0.05mol,
设由Al与碱反应生成的氢气的物质的量为n,则
2Al+2NaOH+2H
2O═2NaAlO
2+3H
2↑
2 2 3
0.01mol 0.01mol n
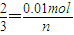
,解得n=0.015mol,
则钠与水反应生成的氢气为0.05mol-0.015mol=0.035mol,
2Na+2H
2O═2NaOH+H
2↑
2 2 1
0.07 0.035
反应后水槽和容器内溶液的总体积为2.0L,溶液中NaOH的浓度为0.050mol?L
-1,
即反应后溶液中NaOH的物质的量为2.0L×0.050mol?L
-1=0.1mol,
则由氧化钠与水反应生成的NaOH为0.1mol-(0.07mol-0.01mol)=0.04mol,
设氧化钠的物质的量为x,则
Na
2O+H
2O═2NaOH
1 2
x 0.04mol
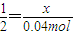
,解得x=0.02mol,
则氧化钠的质量为0.02mol×62g/mol=1.24g,
答:该钠块中氧化钠的质量为1.24g.
点评:本题考查了有关物质的量浓度、物质的量及利用化学反应方程式的计算,计算量较大,注意(4)中明确有关的化学反应是解答本题的关键,并注意NaOH既生成又消耗是学生容易忽略的地方,从而造成计算错误.


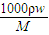 来计算浓度,利用浓硫酸具有腐蚀性的性质来分析应贴的图标,利用配制溶液时溶质的物质的量相等来列式计算;
来计算浓度,利用浓硫酸具有腐蚀性的性质来分析应贴的图标,利用配制溶液时溶质的物质的量相等来列式计算; =
=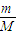 ,并结合物质的构成来分析原子的物质的量,原子的物质的量越多,则原子个数越多;
,并结合物质的构成来分析原子的物质的量,原子的物质的量越多,则原子个数越多;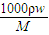 =
=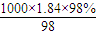 =18.4 mol?L-1,
=18.4 mol?L-1,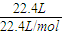 ×1=1mol,
×1=1mol,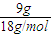 =0.5mol,
=0.5mol,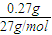 =0.01mol,
=0.01mol,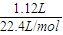 =0.05mol,
=0.05mol,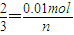 ,解得n=0.015mol,
,解得n=0.015mol,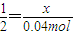 ,解得x=0.02mol,
,解得x=0.02mol,

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
