
分析 ①根据n=$\frac{V}{{V}_{m}}$计算混合气体总物质的量,结合总质量列方程计算CO、CH4各自物质的量,根据V=nVm计算甲烷体积,根据m=nM计算CO质量;
②根据M=ρVm计算气体A的摩尔质量,根据相对氢气密度计算混合气体平均相对分子质量,再根据$\overline{M}$=$\frac{{m}_{总}}{{n}_{总}}$计算.
解答 解:①混合气体总物质的量为$\frac{8.96L}{22.4L/mol}$=0.4mol,
设CO、CH4的物质的量物质的量分别为xmol、ymol,则:
$\left\{\begin{array}{l}{x+y=0.4}\\{28x+16y=7.6}\end{array}\right.$
解得x=0.1,y=0.3
甲烷体积为0.3mol×22.4L/mol=6.72L,
CO质量为0.1mol×28g/mol=2.8g,
故答案为:6.72L;2.8g;
②气体A的摩尔质量为1.25g/L×22.4L/mol=28g/mol,混合气体平均相对分子质量为16.8×2=33.6,
令A、B物质的量分别为a mol、b mol,则:
$\frac{28a+42b}{a+b}$=33.6
整理可得a:b=3:2
则混合气体中A和B的体积比为3:2,
故答案为:3:2.
点评 本题考查物质的量有关计算,侧重考查学生分析计算能力,②中利用十字交叉法更为简单.


 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:解答题
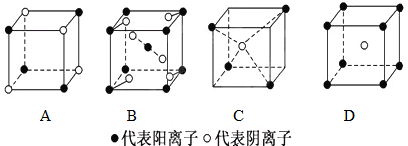
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
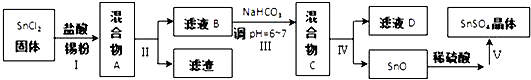
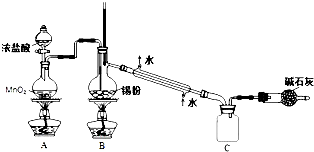
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠跟水反应:Na+H2O═Na++OH-+H2↑ | |
| B. | 向CuCl2溶液中加入氢氧化钠溶液:Cu2++2OH-═Cu(OH)2↓ | |
| C. | 盐酸与碳酸钙反应制备二氧化碳:CO32-+2H+═CO2↑+H2O | |
| D. | 等物质的量硫酸氢钠溶液与氢氧化钡溶液反应:H++OH-═H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漏斗 | B. | 玻璃棒 | C. | 烧杯 | D. | 容量瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,8g O2的体积为5.6L | |
| B. | 标准状况下,22.4 L H2O所含的分子数为NA | |
| C. | 标准状况下,50mL 0.2mol•L-1的盐酸中含有分子数为0.01NA | |
| D. | 常温常压下,10g氖气含有的原子数为0.5NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
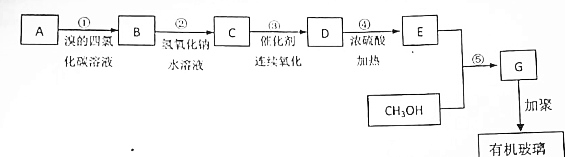
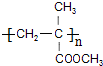 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com