

| 压强p/Pa | 2×105 | 5×105 | 1×106 |
| c(A)/mol•L-1 | 0.08 | 0.20 | 0.44 |
分析 I(1)活泼的铜是负极发生氧化反应,发生吸氧化腐蚀,正极反应式为:O2+4H++4e-=2H2O;
(2)氯化铵受热分解,生成的氨气还原氧化铜,生成铜和氮气,所以反应方程式为:2NH4Cl+3 CuO $\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2↑+2HCl+3H2O;
II(1)由图象可知,加入催化剂,反应速率增大,但催化剂只影响反应速率,不影响平衡移动,以此解答该题;
(2)①当压强为2×105 Pa时,此反应的平衡常数表达式为平衡时生成物浓度幂之积比上反应物浓度幂之积;
②根据压强变化与浓度变化关系分析;
③2×105与5×105 Pa时A的转化率不变,反应时间缩短,1×106 Pa时,A的转化率减小,反应速率增大时间缩短.
解答 解:I(1)活泼的铜是负极发生氧化反应,发生吸氧化腐蚀,正极反应式为:O2+4H++4e-=2H2O,故答案为:氧化,O2+4H++4e-=2H2O;
(2)氯化铵受热分解,生成的氨气还原氧化铜,生成铜和氮气,所以反应方程式为:2NH4Cl+3 CuO $\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2↑+2HCl+3H2O,故答案为:2NH4Cl+3 CuO $\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2↑+2HCl+3H2O;
II(1)加入催化剂的结果一是正、逆反应速率都增大,二是缩短了达到平衡的时间.由此可得:a1<a2、b1<b2、t1>t2,但不使平衡移动推知,阴影面积为反应物浓度的变化,由于催化剂不影响平衡移动,则两图中阴影部分面积相等.
故答案为:②③⑤;
(2)①当压强为2×105 Pa时,此反应的平衡常数表达式为平衡时生成物浓度幂之积比上反应物浓度幂之积,所以K=$\frac{{c}^{p}(C)}{{c}^{m}(A){c}^{n}(B)}$,故答案为:$\frac{{c}^{p}(C)}{{c}^{m}(A){c}^{n}(B)}$;
②由表格数据可知当压强从2×105Pa增大为5×105Pa时,压强增大2.5倍,体积变为$\frac{1}{2.5}$倍,浓度由0.08增大为0.20mol•L-1,也增大2.5倍,所以增大压强平衡不移动,故选:C;
③2×105与5×105 Pa时A的转化率不变,反应时间缩短,1×106 Pa时,平衡逆移,A的转化率减小,反应速率增大,时间缩短,依此作图为: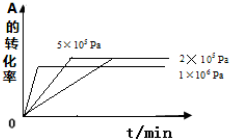 ,
,
故答案为: .
.
点评 本题考查了平衡常数、平衡移动、平衡图象等,综合性较强,难度中等,注意对图象和表格数据的分析是解题的关键,考查了学生分析图象提取图象信息的能力.


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:解答题
 “低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视.所以“低碳经济”正成为科学家研究的主要课题
“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视.所以“低碳经济”正成为科学家研究的主要课题| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径依次增大 | B. | 单质的熔沸点逐渐升高 | ||
| C. | 卤离子的还原性逐渐减弱 | D. | 氢化物的热稳定性依次减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
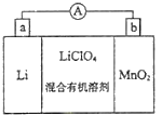 如图是锂锰电池的反应原理示意图,其中电解质KClO4溶于混合有机溶剂中,Li+ 通过电解质迁移入MnO2晶格中,得到LiMnO2.回答下列问题:
如图是锂锰电池的反应原理示意图,其中电解质KClO4溶于混合有机溶剂中,Li+ 通过电解质迁移入MnO2晶格中,得到LiMnO2.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2NO+O2═2NO2 | B. | 3NO2+H2O═2HNO3+NO | ||
| C. | 3H2+N2$?_{催化剂}^{高温高压}$3NH3 | D. | NH3+HNO3═NH4NO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com