
工业上氨气的制取是在高温、高压和催化剂的条件下进行的,并且该反应属于可逆反应,即该反应达到一定限度后,就会在反应物、产物浓度上保持一种动态的平衡(即化学平衡).
(1)请你填写下表中的空白
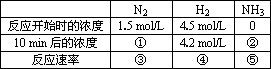
(2)比较是一种重要的化学学习方法.请用比较的方法归纳上表中反应速率与化学方程式中的计量系数的关系:________.
科目:高中化学 来源: 题型:阅读理解
 2CO2+N2
2CO2+N2| 实验编号 | T/℃ | NO初始浓度 mol?L-1 |
CO初始浓度 mol?L-1Com] |
催化剂的比表面积 ㎡?g-1 |
| Ⅰ | 280 | 1.2×10-3 | 5.8×10-3 | 82 |
| Ⅱ | 124 | |||
| Ⅲ | 350 | 124 |
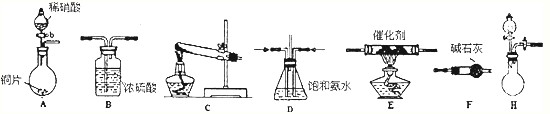
| 试剂组合序号 | 固体试剂(g) | NH3体积(ml) | |
| a | 12.0gCa(OH)2(过量) | 10.8gNH4Cl | 2688 |
| b | 10.8g(NH4)2SO4 | 2728 | |
| c | 12.0gNaOH(过量) | 10.8gNH4Cl | 3136 |
| d | 10.8g(NH4)2SO4 | 3118 | |
| e | 12.0gCaO(过量) | 10.8gNH4Cl | 3506 |
| f | 10.8g(NH4)2SO4 | 3584 | |
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上氨气的催化氧化是制取硝酸的基础.在一定温度下将4mol NH3和4mol O2两种气体混合于2L密闭容器中,发生如下反应:4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g);
4NO(g)+6H2O(g);
△H<0,2分钟末生成了1.2molH2O,则:
(1)用H2O表示的反应速率为________mol/(L•min).
(2)O2在2分钟末的浓度为_______mol /L.
(3)判断该反应达到平衡状态的标志是______(填字母).
a.NH3和NO浓度相等 b.NO百分含量保持不变
c.容器中气体的压强不变 d.NO的生成速率与NH3的消耗速率相等
e.容器中混合气体的密度保持不变 f.O2的质量不再改变
(4)欲提高NH3的转化率,下列措施可行的是 (填字母).
a.向装置中再充入O2 b.改变催化剂
c.增大压强 d.提高温度
查看答案和解析>>
科目:高中化学 来源:2010-2011学年北京市密云二中高二下期3月份月考化学试卷 题型:填空题
工业上氨气的催化氧化是制取硝酸的基础.在一定温度下将4mol NH3和4mol O2两种气体混合于2L密闭容器中,发生如下反应:4NH3(g)+5O2(g)  4NO(g)+6H2O(g);
4NO(g)+6H2O(g);
△H<0,2分钟末生成了1.2molH2O,则:
(1)用H2O表示的反应速率为________mol/(L?min).
(2)O2在2分钟末的浓度为_______mol /L.
(3)判断该反应达到平衡状态的标志是______(填字母).
a.NH3和NO浓度相等 b.NO百分含量保持不变
c.容器中气体的压强不变 d.NO的生成速率与NH3的消耗速率相等
e.容器中混合气体的密度保持不变 f.O2的质量不再改变
(4)欲提高NH3的转化率,下列措施可行的是 (填字母).
a.向装置中再充入O2 b.改变催化剂
c.增大压强 d.提高温度
查看答案和解析>>
科目:高中化学 来源:2012届北京市高二下期3月份月考化学试卷 题型:填空题
工业上氨气的催化氧化是制取硝酸的基础.在一定温度下将4mol NH3和4mol O2两种气体混合于2L密闭容器中,发生如下反应:4NH3(g)+5O2(g)
 4NO(g)+6H2O(g);
4NO(g)+6H2O(g);
△H<0,2分钟末生成了1.2molH2O,则:
(1)用H2O表示的反应速率为________mol/(L•min).
(2)O2在2分钟末的浓度为_______mol /L.
(3)判断该反应达到平衡状态的标志是______(填字母).
a.NH3和NO浓度相等 b.NO百分含量保持不变
c.容器中气体的压强不变 d.NO的生成速率与NH3的消耗速率相等
e.容器中混合气体的密度保持不变 f.O2的质量不再改变
(4)欲提高NH3的转化率,下列措施可行的是 (填字母).
a.向装置中再充入O2 b.改变催化剂
c.增大压强 d.提高温度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com