
【题目】常温下,在20 mL 0.1mol/L Na2CO3溶液中逐滴加入0.1 mol/L 盐酸40 mL,溶液的pH逐渐降低,此时溶液中含碳元素的微粒物质的量浓度的百分含量(纵轴)也发生变化(CO2因逸出未画出),如图所示。下列说法不正确的是( )

A.0.1 mol/L Na2CO3溶液中c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)
B.在A点:c(Na+)> c(CO32-)> c(HCO3-)>c(OH-)>c(H+)
C.常温下CO2饱和溶液的pH约为5.6
D.当加入20 mL盐酸时,混合溶液的pH约为8
【答案】B
【解析】
试题分析:A.碳酸钠溶液中存在电荷守恒,为c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-),A正确;B.根据图象分析,A点为碳酸钠和碳酸氢钠的混合溶液,且c(CO32-)=c(HCO3-),溶液呈碱性,则c(OH-)>c( H+),盐溶液水解程度较小,所以c(CO32-)>c(OH-),则离子浓度大小顺序是c(Na+)>c(CO32-)=c(HCO3-)>c(OH-)>c(H+),B错误;C.pH≈5.6时,溶液浓度不变,溶液达到饱和,说明常温下CO2饱和溶液的pH约为5.6,C正确;D.c(HCO3-)=100%时,溶液的pH=8,说明0.05mol/L NaHCO3溶液的pH=8,当加入20 mL盐酸时Na2CO3溶液和盐酸反应生成碳酸氢钠溶液,D正确,答案选B。


科目:高中化学 来源: 题型:
【题目】下列关于酸、碱、盐的说法中正确的是( )
A.酸根中不可能含有氧元素B.能与碱发生反应生成水的化合物是酸
C.电离时有金属阳离子产生的化合物一定是盐D.酸不可能电离产生金属阳离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液由Na+、Cu2+、Ba2+、Fe3+、AlO2-、CO32-、SO42-、Cl-中的若干种离子组成,取适量该溶液进行如下实验:下列说法正确的是( )
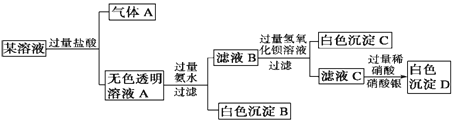
A. 原溶液中一定只存在AlO2-、CO32-、SO42-、Cl- 四种离子
B. 气体A的化学式是CO2,其电子式为O::C::O
C. 原溶液中一定不存在的离子是Cu2+、Ba2+、Fe3+
D. 生成沉淀B的离子方程式为:Al3++ 3OH- = Al(OH)3 ↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某有机物含有4个C,每个C原子都以键长相等的三条单键连接3个C,且整个结构中所有碳碳键之间的夹角都为60°,则下列说法不正确的是
A. 该有机物中C采取sp2杂化
B. 该有机物的一氯代物仅有1种
C. 该有机物的碳原子构成正四面体
D. 该有机物的不饱和度为3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 漂白粉的有效成分是次氯酸钙
B. 实验室制取氯气时,为了防止环境污染,多余的氯气可以用氢氧化钠溶液吸收
C. 钠、铁和铜一样都能在氯气中燃烧生成金属氯化物
D. 干燥的氯气可以使有色布条褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S 和SO2 会对环境和人体健康带来极大的危害,工业上采取多种方法来减少这些有害气体的排放。
I.H2S 的除去
方法1: 生物脱H2S,反应的原理为H2S + Fe2(SO4)3==S↓+2FeSO4+H2SO4、4FeSO4+O2+2H2SO4![]() 2Fe2(SO4)3 +2H2O。
2Fe2(SO4)3 +2H2O。
(1)硫杆菌存在时,FeSO4被氧化的速率是无菌时的5×105 倍,该菌的作用是______。
(2)由图1和图2 判断,使用硫杆菌的最佳条件为_________。若反应温度过高,反应速率下降,其原因是______________。


方法2: 在一定条件下,用H2O2 氧化H2S
(3)随着参加反应的n(H2O2)/n(H2S) 变化,氧化产物不同。当n(H2O2)/n(H2S)=4时,氧化产物 的分子式为________。
II.SO2 的除去
方法1( 双碱法): 用NaOH 吸收SO2 ,并用CaO 使NaOH 再生:NaOH 溶液![]() Na2SO3
Na2SO3
(4)写出过程①的离子方程式:_________________。
(5)CaO 在水中存在如下转化:CaO(s)+H2O(1)= Ca(OH)2(s)![]() Ca2+(aq) +2OH- (aq)。从平衡移动的角度,简述过程②NaOH再生的原理:_______________。
Ca2+(aq) +2OH- (aq)。从平衡移动的角度,简述过程②NaOH再生的原理:_______________。
方法2:用氨水除去SO2
(6)已知25℃,NH3·H2O的Kb=1.8×10-5,H2SO3的Ka1=1.3×10-2,Ka2=6.2×10-8。若氨水的浓度为2.0mol/L,溶液中的c(OH-)=________。将SO2 通入该氨水中,当c(OH-)降至1.0×10-7mol/L时,溶液中的c (SO32-)/c(HSO3-) =_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Atropic 酸(H)是某些具有消炎、镇痛作用药物的中间体,其一种合成路线如下:
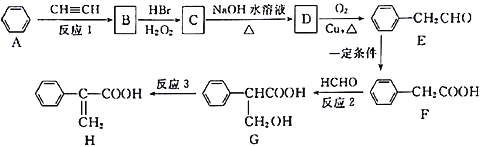
(1)G中含氧官能团的名称是____________;反应1为加成反应,则B的结构简式是________________。
(2)反应2的反应类型为________________,反应3的反应条件为________________。
(3)C→D的化学方程式是________________________________。
(4)写出E与银氨溶液水浴反应的离子方程式_______________________________。
(5)下列说法正确的是________。
a. B中所有原子可能在同一平面上
b. 合成路线中所涉及的有机物均为芳香族化合物
c.一定条件下1mol有机物H最多能与5molH2发生反应
d. G能发生取代、加成、消去、氧化、缩聚等反应
(6)化合物G有多种同分异构体,其中同时满足下列条件:①能发生水解反应和银镜反应; ②能与FeC13发生显色反应;③核磁共振氢谱只有4个吸收峰的同分异构体的结构简式是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近日,中国科学家研发了一种碳修饰的镍基催化剂,实现了木质素选择性氢解得到酚类化合物。请回答下列问题:
(1)基态碳原子的核外电子有____种运动状态, 基态Ni原子的核外电子排布式为_________________。
(2)C、N、O三种元素的第一电离能由大到小的顺序为______________________。
(3)图1所示化合物中碳原子的杂化方式为_________,存在的化学键类型有_________(填标号)。

A.共价键 B.离子键 C.配位键 D.金属键 E.氢键
(4)碳的氧化物CO常作为许多金属配合物的配体,CO与N2互为等电子体,则CO分子中σ键与π键的个数比为______;测得熔点为170℃,预测属于___________晶体。
(5)一种储氢材料由镍、 镁元素组成,其晶胞结构如图2所示,则该晶体的化学式为__________,其晶胞边长为apm,列式计算晶胞密度为___________g/cm3 (不必计算出结果,阿伏加德岁常数的值为NA)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com