
| A、常温下将pH=3的酸HR溶液与pH=11的NaOH溶液等体积混合,若测得pH≠7,则混合溶液的pH>7 |
| B、在0.1mol/L的Na2S溶液中存在:c(OH-)=c(HS-)+c(H2S)+c(H+) |
| C、向Na2CO3粉末中滴加硼酸溶液,有CO2产生 |
| D、自然界各种原生铜的硫化物经氧化、淋滤作用后变为CuSO4溶液,遇到深层的闪锌矿(ZnS)和方铅矿(PbS)可转变为铜蓝(CuS),说明CuS的溶度积小于ZnS、PbS |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、减小、增大 | B、增大、减小 |
| C、不变、不变 | D、不能确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、决定气体体积大小的因素①③ |
| B、决定液体体积大小的因素②③ |
| C、决定固体体积大小的因素①② |
| D、决定气体体积大小的因素①② |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2SO3已部分氧化 |
| B、加入Ba(NO3)2溶液所生成的沉淀一定含有BaSO4 |
| C、加入HNO3后的沉淀一定是BaSO4 |
| D、此实验不能确定Na2SO3是否被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
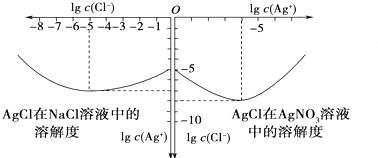
| c(Br-) |
| c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、5mL水 |
| B、10 mL 0.2 mol?L-1 MgCl2溶液 |
| C、20 mL 0.5 mol?L-1 NaCl溶液 |
| D、40mL 0.1 mo1?L-1盐酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com