
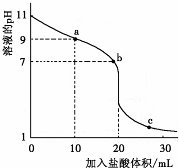
 室温下,将0.1000mol?L-1盐酸滴入20.00mL 0.1000mol?L-1的某一元碱MOH溶液中,溶液pH随加入盐酸体积变化曲线如图所示.下列有关说法正确的是( )
室温下,将0.1000mol?L-1盐酸滴入20.00mL 0.1000mol?L-1的某一元碱MOH溶液中,溶液pH随加入盐酸体积变化曲线如图所示.下列有关说法正确的是( )| A、该一元碱的电离方程式为MOH=M++OH- |
| B、a、b、c三点中,c点水的电离程度最小 |
| C、室温下,MOH的电离常数Kb=1×10-5 |
| D、b点:c(M+)+c(MOH)=c(Cl-) |
| c(M+)c(OH-) |
| c(MOH) |
| c(M+)c(OH-) |
| c(MOH) |
| (0.001)2 |
| 0.1000 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:1 | B、1:3 |
| C、91:94 | D、1:94 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、平衡不移动 |
| B、平衡向正反应方向移动 |
| C、新平衡时各物质的浓度都比原平衡时增大 |
| D、C的质量分数减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子半径X>Y>Z |
| B、离子半径Z>X>Y |
| C、Y(OH)m是一种弱碱性物质 |
| D、单质X常温下可与冷水反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com