
�����뻯ѧ��Ӧ�����仯��ص�������ȷ����( ����)
A��2CH3CH2OH(l)��6O2(g)===4CO2(g)��6H2O(l)����H����1 367 kJ/mol���ɼ��Ҵ�ȼ���Ȧ�H����1367 kJ/mol
B�����ȷ�Ӧ�ķ�Ӧ�������Ǵ������ȷ�Ӧ�ķ�Ӧ����
C��Ӧ�ø�˹���ɣ��ɼ���ijЩ����ֱ�Ӳ����ķ�Ӧ�ʱ�
D��ͬ��ͬѹ�£�H2(g)��Cl2(g)===2HCl(g)�ڹ��պ͵�ȼ�����µĦ�H��ͬ

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�ҹ�ӵ�нϷḻ�ĵ�����Դ���俪������ǰ�����������й��ڵ�����˵����ȷ����(����)
�ٿ�������ϴԡ�������Լ���ů�ȷ��桡����ú̿��ʯ�͡���Ȼ��һ�����ǻ�ʯ��Դ������ҪԴ�ڵ����ڲ�������Ԫ��˥��������������������ˮ��Ͽ��γ���ˮ�͵��ȣ��ͷ���ʽ֮һ����Ȫ
A���٢ڢ� B���٢ڢ�
C���٢ۢ� D���ڢۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���в��ֶ�����Ԫ�ص����ʻ�ԭ�ӽṹ���±���
| Ԫ�ر�� | Ԫ�����ʻ�ԭ�ӽṹ |
| T | M���ϵ�������K���ϵĵ�������3�� |
| X | �����������Ǵ�����������2�� |
| Y | �����µ���Ϊ˫ԭ�ӷ��ӣ����⻯��ˮ��Һ�ʼ��� |
| Z | Ԫ����������ǣ�7�� |
(1)X��ԭ�ӽṹʾ��ͼΪ________��
(2)Ԫ��Y����Ԫ���γ�һ������YH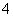 ��д�������ĵ���ʽ________(��Ԫ�ط��ű�ʾ)��
��д�������ĵ���ʽ________(��Ԫ�ط��ű�ʾ)��
(3)Ԫ��Z��Ԫ��T��ȣ��ǽ����Խ�ǿ����______(��Ԫ�ط��ű�ʾ)�����б�������֤����һ��ʵ����________��
a��������Z�ĵ��ʺ�T�ĵ���״̬��ͬ
b. Z���⻯���T���⻯���ȶ�
c��һ��������Z��T�ĵ��ʶ���������������Һ��Ӧ
(4)̽Ѱ���ʵ����ʲ�������ѧϰ����Ҫ����֮һ��T��X��Y��Z����Ԫ�ص�����������ˮ�����л�ѧ�������Բ�ͬ���������ֵ���(д������Ԫ�ص�����������ˮ����Ļ�ѧʽ)________��������__________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
1�����̬����2����Ȼ���ǡ����ȫ������Ӧ����������ܺ�8�����������ȡ����Ӧ���ɴ˿����ƶ�ԭ��̬����(�������������ͬ�����²ⶨ)( )
A����Ȳ B��1,3-����ϩ C����Ȳ D����Ȳ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�¡��¹�ϩ�Ľṹ��ͼ��ʾ��
 ������������1��1�����ӳɷ�Ӧ�IJ��������˳���칹������������У� ��
������������1��1�����ӳɷ�Ӧ�IJ��������˳���칹������������У� ��
A��3�� B��4�� C��5�� D��6��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 N2(g)+3H2(g)
N2(g)+3H2(g) 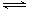 2NH3(g)��Ӧ���̵������仯����ͼ��ʾ����֪����1 mol NH3(g)�Ħ�H=-46 kJ��mol-1����ش��������⣺
2NH3(g)��Ӧ���̵������仯����ͼ��ʾ����֪����1 mol NH3(g)�Ħ�H=-46 kJ��mol-1����ش��������⣺
��1��ͼ��A��C�ֱ��ʾ�����������������������÷�Ӧʹ�ô�������ʹͼ��B�������ǽ���?�� ������
��2��ͼ�Ц�H=����������kJ��mol-1��
��3����֪����ʱ������ϵ�и�����Ũ����ʱ��仯��������ͼ��ʾ��
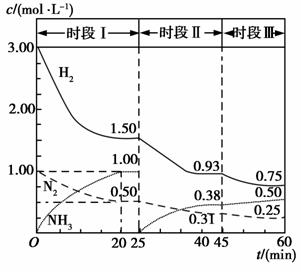
����0��5 L�����з�����Ӧ��ǰ20 min�ڣ�v(NH3)��________���ų�������Ϊ________��
��45 minʱ��ȡ�Ĵ�ʩ��_______________________��
�۱Ƚ�I��II��IIIʱ�εĻ�ѧƽ�ⳣ�����ֱ���K1��K2��K3��ʾ����С________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��25 mL 0.1 mol/L NaOH��Һ����μ���0.2 mol/L CH3COOH��Һ��������ͼ��ʾ���й�����Ũ�ȹ�ϵ�Ƚ���ȷ��
��A����A��B������һ�㣬��Һ��һ������
c(Na+) > cCH3COO��) > c(OH��) > c(H+)
B����B�㣬a > 12.5������c(Na+) = c(CH3COO��) > c(OH��) = c(H+)
C����C�㣺c(Na+) > c(CH3COO��) > c(H+) > c(OH��)
D����D�㣺c(CH3COO��) + c(CH3COOH) = 2 c(Na+)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��֪����ʽΪC12H12������A�Ľṹ��ʽΪ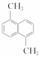 ��A�����ϵĶ��������9��ͬ���칹�壬�ɴ��ƶ�A�����ϵ���������ͬ���칹����ĿΪ (����)��
��A�����ϵĶ��������9��ͬ���칹�壬�ɴ��ƶ�A�����ϵ���������ͬ���칹����ĿΪ (����)��
A��9�� B��10�� C��11�� D��12��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com