
【题目】在溶液中加入足量Na2O2后仍能大量共存的离子组是
A. ![]() 、Ba2+、
、Ba2+、![]() 、
、![]() B. K+、
B. K+、![]() 、
、![]() 、
、![]()
C. Ca2+、Mg2+、![]() 、
、![]() D. Na+、
D. Na+、![]() 、
、![]() 、
、![]()
 步步高达标卷系列答案
步步高达标卷系列答案科目:高中化学 来源: 题型:
【题目】乙醇分子中不同的化学键如图所示,对乙醇在各种反 应中应断裂的键说明不正确的是

A. 和钠作用键①断
B. 和浓H2SO4作用到170℃,键②和键⑤断
C. 和乙酸、浓H2SO4共热,键②断
D. 在Cu作用和O2反应,键①和键③断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化中属于吸热反应的是
①液态水汽化 ②碳酸钙分解 ③苛性钠固体溶于水 ④C与H2O制水煤气 ⑤生石灰跟水反应生成熟石灰 ⑥干冰升华
A. ①②④B. ②④C. ③⑤D. ①②④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚(CH3OCH3)是一种重要的清洁燃料,也可替代氟利昂作做制冷剂等,对臭氧层无破坏作用.工业上以水煤气(CO、H2)为原料生产二甲醚CH3OCH3的新工艺主要发生三个反应:
2H2(g)+CO(g)![]() CH3OH(g)△H=-90.0kJ·mol-1①
CH3OH(g)△H=-90.0kJ·mol-1①
2CH3OH(g)![]() CH3OCH(g)+H2O (g)△H=-24.5kJ·mol-1②
CH3OCH(g)+H2O (g)△H=-24.5kJ·mol-1②
CO(g)+H2O(g)![]() CO2(g)+H2(g)△H=-41.1kJ·mol-1③
CO2(g)+H2(g)△H=-41.1kJ·mol-1③
回答下列问题:
(1)新工艺的总反应3H2+3CO![]() CH3OCH3+CO2的热化学方程式为____________________。
CH3OCH3+CO2的热化学方程式为____________________。
(2)已知一些共价键的键能如下:
化学键 | H-H | C-H | C-O | O-H |
键能(kJ·mol-1) | 436 | 414 | 326 | 464 |
运用反应①计算一氧化碳中碳氧共价键的键能____________kJmol-1。
(3)某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应10min后,达到平衡时测得c(CO)=0.2mol/L,计算此温度下的平衡常数K=____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能影响水的电离平衡,并使溶液中的c(H+)>c(OH-)的措施是( )
A. 向水中通入SO2 B. 将水加热煮沸
C. 向纯水中投入一小块金属钠 D. 向水中加入NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷是地壳中含量较为丰富的非金属元素,主要以难溶于水的磷酸盐如Ca3(PO4)2等形式存在。它的单质和化合物在工农业生产中有着重要的应用。
(1)白磷(P4)可由Ca3(PO4)2、焦炭和SiO2在一定条件下反应获得。相关热化学方程式如下:
2Ca3(PO4)2(s)+10C(s)=6CaO(s)+P4(s)+10CO(g) ΔH1=+3359.26 kJ·mol-1
CaO(s)+SiO2(s)=CaSiO3(s) ΔH1=-89.61 kJ·mol-1
2Ca3(PO4)2(s)+6SiO2(s)+10C(s)=6CaSiO3(s)+P4(s)+10CO(g) ΔH3
则ΔH3=________kJ·mol-1。
(2)白磷中毒后可用CuSO4溶液解毒,解毒原理可用下列化学方程式表示:
11P4+60CuSO4+96H2O=20Cu3P+24H3PO4+60H2SO4
60 mol CuSO4能氧化白磷的物质的量是________。
(3)磷的重要化合物NaH2PO4、Na2HPO4和Na3PO4可通过H3PO4与NaOH溶液反应获得,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系如下图所示。
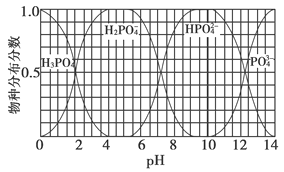
①为获得尽可能纯的NaH2PO4,pH应控制在________;pH=8时,溶液中主要含磷物种浓度大小关系为________。
②Na2HPO4溶液显碱性,若向溶液中加入足量的CaCl2溶液,溶液则显酸性,其原因是________(用离子方程式表示)。
(4)磷的化合物三氯氧磷(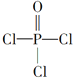 )与季戊四醇(
)与季戊四醇( )以物质的量之比2:1反应时,可获得一种新型阻燃剂中间体X,并释放出一种酸性气体。季戊四醇与X的核磁共振氢蛮如下图所示:
)以物质的量之比2:1反应时,可获得一种新型阻燃剂中间体X,并释放出一种酸性气体。季戊四醇与X的核磁共振氢蛮如下图所示:
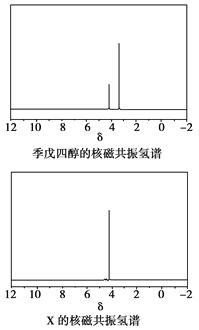
①酸性气体是______________________(填化学式)。
②X的结构简式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)通过NOx传感器可监测NOx的含量,其工作原理示意图如下:
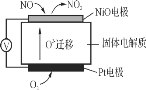
①Pt电极上发生的是_______(填“氧化”或“还原”)反应。
②写出NiO电极的电极反应式:___________________________________。
(2)下图是利用甲烷燃料电池电解50 mL 2 mol·L-1的氯化铜溶液的装置示意图:
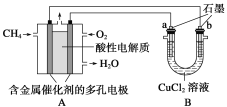
请回答:①甲烷燃料电池负极反应式是_______________________________________。
②当线路中有0.1 mol电子通过时,________(填“a”或“b”)极增重________ g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨工业对国民经济和社会发展具有重要意义。对于密闭容器中的反应:N2(g)+3H2(g)![]() 2NH3(g),在673 K、30 MPa下,n(NH3)和n(H2)随时间变化的关系如图所示。下列叙述正确的是
2NH3(g),在673 K、30 MPa下,n(NH3)和n(H2)随时间变化的关系如图所示。下列叙述正确的是

A. 点a的正反应速率比点b的小
B. 点c处反应达到平衡
C. 点d(t1时刻)和点e(t2时刻)处n(N2)不一样
D. 点e处反应达到平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等。下列判断不正确的是( )
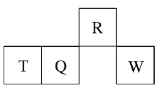
A. 最简单气态氢化物的热稳定性:R>Q
B. 最高价氧化物对应水化物的酸性:Q<W
C. 原子半径:T>Q>R
D. 单质T与NaOH溶液不反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com