
【题目】自然界中存在大量的金属元素,其中钠、镁、铝、铁、铜等在工农业生产中有着广泛的应用。回答下列问题:
(1)CuSO4和Cu(NO3)2中阳离子核外电子排布式为__________,N、O、S元素的原子对键合电子吸引力最大的是___________。
(2)在硫酸铜溶液中加入过量KCN能生成配离子[Cu(CN)4]2-,1mol CN中含有的π键的数目为__________。与CN互为等电子体的离子或分子有__________(写出一种即可)。
(3)[Cu(NH3)4]2+中,提供孤对电子的是___________。Cu(NH3)2Cl2有两种同分异构体,其中一种可溶于水,则此种化合物是___________(填“极性”或“非极性”)分子,由此推知[Cu(NH)4]2+的空间构型是___________。(填“平面正方形”或“正四面体”)
(4)NH3中N原子的杂化方式是___________,硫元素对应的含氧酸酸性是H2SO4强于H2SO3,其原因为___________。
(5)铜的一种氧化物晶体结构如图所示,该氧化物的化学式是___________。若该晶体结构为长方体,其参数如图,阿伏加德罗常数为NA,则该氧化物的密度为___________g/cm3。
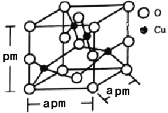
【答案】[Ar]3d9或1s22s22p63s23p63d9 O 2NA或2×6.02×1023 C22-、CO、N2(其它答案合理均可以) NH3 极性 平面正方形 sp3 H2SO4与H2SO3分别可表示为(HO)2SO2和(HO)2SO,前者非羟基氧(2个)多于后者的非羟基氧(1个)的数目,使H2SO4中的S-O-H中的O的电子更偏向于S,越容易电离出H+,酸性更强 CuO 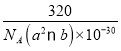
【解析】
(1)CuSO4和Cu(NO3)2中阳离子为Cu2+,Cu是29号元素,核外电子排布式为1s22s22p63s23p63d104s1,先失去4s能级1个电子,再失去3d能级1个形成Cu2+;元素的非金属性越强,其对键合电子吸引力就越强;
(2)共价单键只有1个σ键;共价双键含有1个σ键、1个π键;共价三键含有1个σ键、2个π键;原子总数相同、价电子总数也相同的微粒互为等电子体,CN-与N2互为等电子体,二者价键结构相同,即CN-中含有C≡N三键,三键含有1个σ键、2个π键;
(3)配位体中的中心原子提供孤对电子,根据Cu(NH3)2Cl2有两种同分异构体,结合相似性相溶原理分析物质的分子极性和空间构型;
(4)根据NH3的价层电子对数,得出杂化类型;
非金属含氧酸的酸性大小取决于非羟基氧的数目,非羟基氧原子数目越多,物质的酸性就越强;
(5)根据均摊法可以计算晶胞中含有的Cu、O原子个数,然后根据ρ=![]() 计算密度。
计算密度。
(1)CuSO4和Cu(NO3)2中阳离子为Cu2+,Cu是29号元素,核外电子排布式为1s22s22p63s23p63d104s1,先失去4s能级1个电子,再失去3d能级1个形成Cu2+,因此Cu2+的核外电子排布式是1s22s22p63s23p63d9,也可写为[Ar]3d9;元素的非金属性越强,其对键合电子吸引力越强,S、O、N三种元素的非金属性O>N>S,则三种原子对键合电子吸引力由大到小的顺序是O>N>S,所以对键合电子吸引力最大的是O;
(2)在CN-中存在C、N三键,其中含有1个σ键,两个π键,则1mol CN-中含有的π键的数目为2NA;
等电子体是指原子总数相同,价电子总数也相同的微粒,所以与CN-互为等电子体的离子有:C22-,分子有N2、CO;
(3)在[Cu(NH3)4]2+中,提供孤对电子的是配位体NH3分子中的N原子;Cu(NH3)2Cl2有两种同分异构体,其中一种易溶于水,根据相似相溶原理,水是极性分子,所以该分子应该为极性分子;既然存在两种同分异构体,所以[Cu(NH3)4]2+的空间构型应该是平面正方形;
(4)NH3的价层电子对数=3+![]() =4,所以N原子杂化类型为sp3杂化;
=4,所以N原子杂化类型为sp3杂化;
非金属含氧酸的酸性大小取决于非羟基氧的数目,H2SO4的非羟基氧2个,H2SO3的非羟基氧1个,使得H2SO4中的S-O-H中的O的电子更偏向于S,越容易电离出氢离子,酸性更强,所以酸性H2SO4强于H2SO3;
(5)如图所示,根据均摊法可以计算出Cu全部在体内:4个;O在顶点、面上、棱上和体心,即8×![]() +4×
+4×![]() +2×
+2×![]() +1=4,所以Cu和O原子个数最简整数比为1:1,因此物质的化学式为CuO;晶体密度ρ=
+1=4,所以Cu和O原子个数最简整数比为1:1,因此物质的化学式为CuO;晶体密度ρ=![]() =
=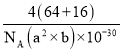 g/cm3=
g/cm3=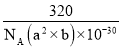 g/cm3。
g/cm3。


科目:高中化学 来源: 题型:
【题目】金属钠是在1807年通过电解氢氧化钠制得的,这个原理应用于工业生产,约在1891年才获得成功。1921年实现了电解氯化钠制钠的工业方法,其反应原理是:2NaCl(熔融)![]() 2Na+Cl2↑。回答下列有关单质钠的问题:
2Na+Cl2↑。回答下列有关单质钠的问题:
(1)下列各项中属于保存金属钠的正确方法是____。
A.放在棕色瓶中 B.放在细沙中C.放在水中 D.放在煤油中
(2)将一小块钠放在水平放置的试管中部,用酒精灯加热充分反应(如图Ⅰ所示),请写出该反应的化学方程式____________,生成物的颜色为____。将该试管冷却后直立,滴加几滴水(如图Ⅱ所示),发生反应的化学方程式为____________,检验该反应产生的气体的方法是________________。

(3)Na、Na2O、Na2O2、NaOH久置空气中最终都是变为____________(填化学式);过氧化钠与CO2反应的化学方程式__________________________。因此,过氧化钠可作为呼吸面具和潜水艇的氧气来源。
(4)一小块金属钠投入CuCl2溶液中,发生反应的方程式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是某有机物分子X的球棍模型(图中不同的小球分别代表C、H、O三种原子;球与球之间的短线代表化学键,如单键或双键等)。下列说法中正确的是()
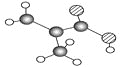
A.X属于羧酸,是乙酸的同系物
B.X可以发生加成反应和取代反应
C.与X含有相同官能团的结构还有1种
D.X分子中的4个碳原子,肯定不在同一平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关Fe2(SO4)3溶液的叙述正确的是
A.该溶液中K+、Fe2+、SCN-、Br-可以大量共存
B.和KI溶液反应的离子方程式:Fe3++2I-===Fe2++I2
C.和Ba(OH)2溶液反应的离子方程式:Fe3++SO42-+Ba2++3OH-==Fe(OH)3↓+BaSO4↓
D.1 L 0.1 mol·L-1该溶液和足量的Zn充分反应,生成11.2 g Fe
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】综合利用CO2、CO对构建低碳社会有重要意义。CO和H2在催化剂作用下发生如下反应:CO(g)+2H2(g) ![]() CH3OH(g)。对此反应进行如下研究:某温度下在一恒压容器中分别充入2.4 mol CO和2 mol H2,达到平衡时容器体积为4 L,且含有0.8 mol CH3OH(g),写出必要的计算过程进行计算:
CH3OH(g)。对此反应进行如下研究:某温度下在一恒压容器中分别充入2.4 mol CO和2 mol H2,达到平衡时容器体积为4 L,且含有0.8 mol CH3OH(g),写出必要的计算过程进行计算:
(1)该反应的化学平衡常数_____________________。
(2)此时向容器中再通入0.7 mol CO气体,判断平衡移动的方向________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用黑钡灰(主要成分为BaS)与软锰矿(主要成分为MnO2)为原料制取Ba(OH)2·8H2O和MnCO3的工艺流程如下:
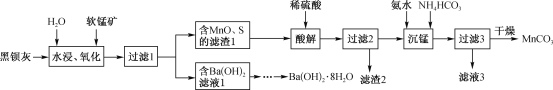
回答下列问题:
(l)“水浸、氧化”时,BaS先转化为Ba(OH)HS溶液,MnO2再氧化Ba(OH)HS。写出第二步反应的化学方程式:_________________________。
(2)过滤1所得“Ba(OH)2滤液”制得Ba(OH)2·8H2O,还需经过的具体实验操作有_________,经干燥得到Ba(OH)2·8H2O产品[已知Ba(OH)2在20℃、60℃、80℃时溶解度依次为:3.76g、17.65g、101.4g]。
(3)“滤渣2”的主要成分为_______(填化学式);“沉锰”时发生反应的离子方程式为________;“滤液3”中可回收的产品为__________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出铝丝与硫酸铜溶液的化学方程式,并用双线桥标出电子的转移。化学方程式: _______________;氧化剂:__________ ,还原剂: __________,氧化产物:___________ ,还原产物:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烷的分子结构可简写成键线型结构![]() 。有机物A的键线式结构为
。有机物A的键线式结构为![]() ,有机物B与等物质的量的H2发生加成反应可得到有机物A,下列有关说法错误的是
,有机物B与等物质的量的H2发生加成反应可得到有机物A,下列有关说法错误的是
A.有机物A的一氯代物只有5种
B.用系统命名法命名有机物A,名称为2,2,3-三甲基戊烷
C.有机物A的分子式为C8H16
D.B的结构可能有3种,其中一种的名称为3,4,4-三甲基-2-戊烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列装置不能达到有关实验目的的是( )
A.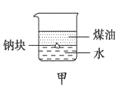 用甲图装置证明ρ(煤油)<ρ(钠)<ρ(水)
用甲图装置证明ρ(煤油)<ρ(钠)<ρ(水)
B.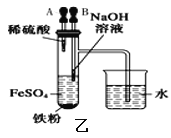 用乙图装置制备Fe(OH)2
用乙图装置制备Fe(OH)2
C.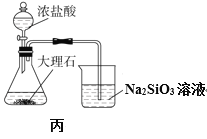 用丙图装置验证酸性:盐酸>碳酸>硅酸
用丙图装置验证酸性:盐酸>碳酸>硅酸
D.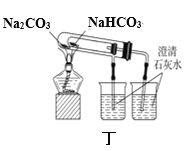 用丁图装置比较NaHCO3和Na2CO3的热稳定性
用丁图装置比较NaHCO3和Na2CO3的热稳定性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com