
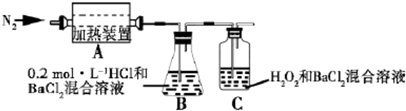
分析 ①A中固体充分加热较长时间后,通入氮气目的是使分解生成的气体在BC装置中完全吸收;
②装置B中BaC12溶液的作用是为了检验分解产物中是否有SO3气体生成,若含有该气体,会生成硫酸钡白色沉淀,观察到的观象为溶液变浑浊;
③C中有白色沉淀生成,是因为SO2被双氧水氧化成SO42-,SO42-再与Ba2+结合成沉淀BaSO4,则C中发生的反应为SO2+H2O2+Ba2+=BaSO4↓+2H+.
解答 解:硫酸亚铁铵在 500℃时隔绝空气加热完全分解,发生了氧化还原反应,Fe元素生成FeO和Fe2O3,部分Fe元素失电子发生氧化反应,气体产物可能有NH3、SO3、H2O、N2,部分N元素失电子发生氧化反应,所以还有得电子的元素发生还原反应,硫酸亚铁铵中S元素得电子发生还原反应,所以还生成SO2,
①A中固体充分加热较长时间后,通入氮气,目的是使分解产生的气体在B、C装置中被充分吸收,
故答案为:使分解产生的气体在B、C装置中被充分吸收;
②装置B中BaC12溶液的作用是为了检验分解产物中是否有SO3气体生成,若含有该气体,会生成硫酸钡白色沉淀,观察到的观象为溶液变浑浊;
故答案为:溶液变浑浊或出现白色沉淀;
③C中有白色沉淀生成,是因为SO2被双氧水氧化成SO42-,SO42-再与Ba2+结合成沉淀BaSO4,则C中发生的反应为SO2+H2O2+Ba2+=BaSO4↓+2H+,故答案为:SO2+H2O2+Ba2+=BaSO4↓+2H+ (或 SO2+H2O2=2H++SO42-、SO42-+Ba2+=BaSO4↓).
点评 本题考查物质的鉴别和检验,为高频考点,把握物质的性质、发生的反应为解答该题的关键,侧重分析和应用能力的考查,注意氧化还原反应的应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | Na2CO3→NaOH | B. | BaCl2→Ba(OH)2 | C. | FeCl3→Fe(OH)3 | D. | CaCO3→CaCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由NO2和N2O4组成的平衡体系加压后颜色先变深后变浅 | |
| B. | 增大压强可加快SO2转化为SO3的速率 | |
| C. | 黄绿色的氯水光照后颜色变浅 | |
| D. | 在含有Fe(SCN)3的红色溶液中加铁粉,振荡静置,溶液颜色变浅或褪去 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeS2作还原剂,铁元素被还原 | |
| B. | Fe2O3和SO2都既是氧化产物又是还原产物 | |
| C. | 每生成1 mol Fe2O3,有4mol硫被氧化 | |
| D. | 每1 mol硫被氧化,转移电子5.5mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO HNO3 | B. | CH2=CH2 CH3CHO | C. | Fe FeCL3 | D. | Si H2SiO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学电源有一次电池、二次电池和燃料电池等,一次电池只能放电,不能充电 | |
| B. | 铅蓄电池应用广泛,是一种常见的可充电电池,放电过程中电解质溶液密度逐渐增大 | |
| C. | 燃料电池具有能量利用率高、可连续使用和污染轻等优点 | |
| D. | 锂电池是一种高能电池,体积小、重量轻,单位质量电极放出的电能多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | |
| Z | W | |
| T |
| A. | 氢化物稳定性Y比W强,是因为Y的氢化物中存在氢键 | |
| B. | XY2、XW2、ZY2熔沸点依次增大,都是由共价键形成的分子晶体 | |
| C. | 一定条件下,X单质能与ZY2反应生成Z单质,说明X的非金属性比Z强 | |
| D. | 根据元素周期律,可以推测T元素的单质具有半导体特性,钠能与T形成Na2T2化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
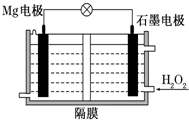 Mg-H2O2电池可用于驱动无人驾驶的潜航器.该电池以海水为电解质溶液,示意图如下.该电池工作时,下列说法正确的是( )
Mg-H2O2电池可用于驱动无人驾驶的潜航器.该电池以海水为电解质溶液,示意图如下.该电池工作时,下列说法正确的是( )| A. | Mg电极是该电池的正极 | B. | H2O2在石墨电极上发生氧化反应 | ||
| C. | 石墨电极附近溶液的pH增大 | D. | 电子从石墨电极移向Mg电极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com