
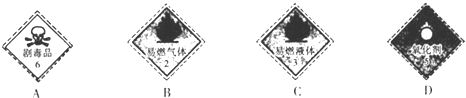
 .
.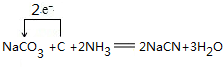 .
.
分析 (1)NaCN是有剧毒的药品,据此选择;
(2)NaCN属于离子化合物,钠离子直接用离子符号表示,阴离子需要标出所带电荷及最外层电子;
(3)根据Kh=$\frac{c(HCN)×c(O{H}^{-})}{c(C{N}^{-})}$计算出水解平衡常数,比较NaCN的水解平衡常数和HCN的电离平衡常数可判断溶液的酸碱性;
(4)根据工业流程可知,NaCN与FeSO4反应生成Fe(CN)2白色沉淀,Fe(CN)2继续与NaCN溶液反应生成Na4[Fe(CN)6],Na4[Fe(CN)6]被氯气氧化成Na3[Fe(CN)6],Na3[Fe(CN)6]与硫酸亚铁反应生成蓝色染料为Fe3[Fe(CN)6]2,据此答题;
(5)流程分析含CN-废水调整溶液PH加入NaClO溶液,氧化CN-离子反应生成CNO-的废水,含Cr2O72-的废水调整溶液PH加入Na2S2O3发生氧化还原反应得到含硫酸根离子的废水,和含CNO-的废水继续处理得当待测水样;
①从流程分析物质的转化关系和试剂选择分析所用方法;
②利用每0.4molCr2O72-转移2.4mol的电子来计算被还原后Cr元素的化合价,再书写离子方程式;
③根据氧化还原反应中得失电子数相等,再结合原子守恒进行计算.
解答 解:(1)NaCN是有剧毒的药品,应贴在装有氰化钠容器上的是剧毒标志,
故答案为:A;
(2)NaCN为离子化合物,电子式为 ,
,
故答案为: ;
;
(3)根据元素守恒可知,纯碱、焦炭、氨气反应制取 NaCN,同时会生成水,反应的化学方程式,并用单线桥标明电 子转移的方向和数目为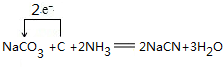 ,
,
故答案为: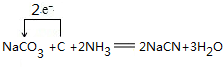 ;
;
(4)根据Kh=$\frac{c(HCN)×c(O{H}^{-})}{c(C{N}^{-})}$可知,Kh=$\frac{c(HCN)×c(O{H}^{-})}{c(C{N}^{-})}$=$\frac{c(HCN)•c(O{H}^{-})•c({H}^{+})}{c(C{N}^{-})•c({H}^{+})}$=$\frac{{K}_{w}}{{K}_{a}}$=$\frac{1{0}^{-14}}{6.2×1{0}^{-10}}$=1.6×10-5>6.2×10-10,即水解平衡常数大于电离平衡常数,所以溶液呈碱性,
故答案为:碱;Kh=$\frac{{K}_{w}}{{K}_{a}}$=$\frac{1{0}^{-14}}{6.2×1{0}^{-10}}$=1.6×10-5>6.2×10-10,即水解平衡常数大于电离平衡常数,所以溶液呈碱性;
(5)①从流程看,CN-转化为CNO-,化合价升高被氧化剂氧化,Cr2O72-转化为Cr3+化合价降低,故还原剂还原,故采用方法为氧化还原法;
故答案为:d;
②每0.4molCr2O72-转移2.4mol的电子,设还原后Cr元素的化合价为x,则0.4mol×2×(6-x)=2.4mol,解得x=+3,则离子反应为3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O,
故答案为:3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O;
③处理1mol Cr2O72-,需加入a mol FeSO4•7H2O,根据铬原子守恒得,1mol Cr2O72-完全反应后生成 $\frac{2}{2-x}$molFeⅡ[FeⅢx•CrⅢ2-x]O4,根据铁原子守恒得amol=$\frac{2(1+x)}{2-x}$mol①,该反应中得失电子数相等,1mol×2×3=$\frac{2}{2-x}$mol×(3-2)×x,解得x=1.5,将x=1.5代入①得a=10,
故答案为:D.
点评 本题考查物质的制备实验方案的设计,侧重于学生的分析能力、实验能力和计算能力的考查,为高考常见题型,注意根据流程图把握实验的原理和操作方法,注意运用电子守恒进行计算,难度中等.


科目:高中化学 来源: 题型:多选题
| A. | 取代反应 | B. | 加成反应 | C. | 酯化反应 | D. | 氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
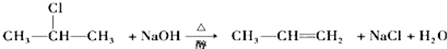
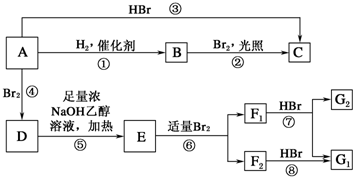
 ;A的结构简式为(CH3)2C═C(CH3)2;E的结构简式为
;A的结构简式为(CH3)2C═C(CH3)2;E的结构简式为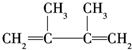 ;F1的结构简式为
;F1的结构简式为
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 油脂、淀粉、蛋白质和维生素等均为高分子化合物 | |
| B. | 等质量的乙烷、乙烯、苯充分燃烧,消耗氧气的量由少到多 | |
| C. | 乙烯能使酸性高锰酸钾溶液和溴水褪色,二者反应原理相同 | |
| D. | 乙醇、乙酸和乙酸乙酯能用饱和Na2CO3溶液鉴别 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电过程是电能转化为化学能的过程 | |
| B. | 充电时阳极反应:Ni(OH)2-e-+OH-═NiOOH+H2O | |
| C. | 放电时正极极附近溶液的pH变小 | |
| D. | 放电时电解质溶液中的OH-向正极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HOCH2CH2CHO | |
| B. | 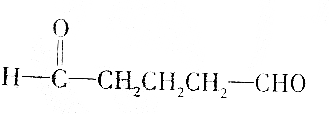 | |
| C. | 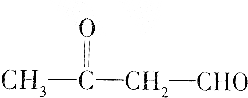 | |
| D. | 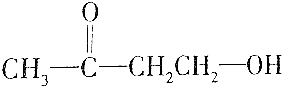 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
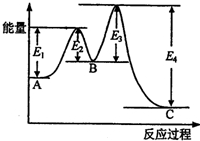 某反应由两步反应A?B?C构成,它的反应能量曲线如图所示(E1、E2、E3、E4表示活化能).下列有关叙述正确的是( )
某反应由两步反应A?B?C构成,它的反应能量曲线如图所示(E1、E2、E3、E4表示活化能).下列有关叙述正确的是( )| A. | 两步反应均为吸热反应 | B. | 稳定性C>A>B | ||
| C. | A与C的能量差为E4 | D. | A?C反应,反应条件一定要加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 侯氏制碱法是先将CO2通入饱和NaCl溶液后,再通入NH3 | |
| B. | 新型材料聚酯纤维、光导纤维都属于有机高分子材料 | |
| C. | PM2.5是指大气中直径≤2.5×10-6m的颗粒物(气溶胶),可通过加水吸收后再利用过滤的方法分离PM2.5微粒和可溶性吸附物 | |
| D. | “神十”航天服是由碳化硅陶瓷和碳纤维复合而制成的,它是一种新型无机非金属材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | D>B>A>C>E | B. | D>A>B>C>E | C. | A>B>C>E>D | D. | D>E>B>A>C |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com