
常温下,下列各组离子在指定溶液中能大量共存的是 ( )
A.无色溶液中:ClO-、MnO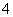 、Al3+、K+
、Al3+、K+
B.1.0 mol·L-1的Na[Al(OH)4]溶液中:Cl-、HCO 、K+、Ca2+
、K+、Ca2+
C.在强碱性环境中:[Al(OH)4]-、SiO 、Na+、K+
、Na+、K+
D.能使甲基橙显红色的溶液中:NH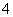 、[Al(OH)4]-、Na+
、[Al(OH)4]-、Na+
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
某化学兴趣小组设计了图示实验装置(图中省略了夹持仪器)来测定某铁碳合金中铁的质量分数。
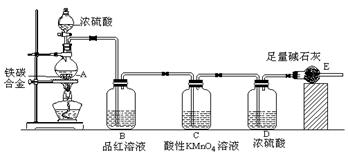
(1)m g铁碳合金中加入过量浓硫酸,未点燃酒精灯前,A、B均无明显现象,其原因是:
①常温下碳与浓硫酸不反应; ② 。
(2)写出加热时A中碳与浓硫酸发生反应的化学方程式 。
(3)B中的现象是: ;C的作用是: 。
(4)待A中不再逸出气体时,停止加热,拆下E并称重,E增重b g。则铁碳合金中铁的质量分数为 (写表达式)。
(5)甲同学认为利用此装置测得铁的质量分数偏大,请你写出可能的原因: 。
(6)本套装置在设计上存在缺陷,其中导致测得铁的质量分数偏低的是
(答一条即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关晶体的说法中一定正确的是( )
①依据构成粒子的堆积方式可将晶体分为金属晶体、离子晶体、分子晶体、原子晶体; ②由原子直接构成的晶体就是原子晶体; ③分子晶体的堆积均采取分子密堆积 ;④NaF、MgF2 、SiF4三种晶体的熔点依次升高;⑤金属键只存在于金属晶体中; ⑥离子键只存在于离子晶体中; ⑦H2O的性质非常稳定,原因在于分子之间存在氢键; ⑧SO2和SiO2晶体在熔化时破坏的作用力相同
A.①⑤⑥⑦ B.只有⑥ C.②③⑤⑥ D.①②⑤⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
铝是中学化学学习阶段的唯一一种既能与酸(非氧化性酸)反应又能与强碱溶液反应放出H2的金属,就铝的这一特殊性质回答下列问题:
(1)等质量的两份铝分别与足量的盐酸、氢氧化钠溶液反应,所得H2的体积之比是________。
(2)足量的两份铝分别投入到等体积、等物质的量浓度的盐酸、氢氧化钠溶液中,产生H2的体积之比是________。
(3)足量的两份铝分别投入到等体积、一定物质的量浓度的HCl、NaOH溶液中,二者产生的H2相等,则HCl和NaOH的物质的量浓度之比是________。
(4)甲、乙两烧杯中各盛有100 mL 3 mol·L-1的盐酸和NaOH溶液,向两烧杯中分别加入等质量的铝粉,反应结束后,测得生成的气体体积比为V(甲)∶V(乙)=1∶2,则加入铝粉的质量为 ( )
A.5.4 g B.3.6 g C.2.7 g D.1.8 g
查看答案和解析>>
科目:高中化学 来源: 题型:
用含少量镁粉的铝粉制取纯净的氢氧化铝,下列操作步骤中最恰当的组合是 ( )
①加盐酸溶解 ②加烧碱溶液溶解 ③过滤 ④通入过量CO2生成Al(OH)3沉淀 ⑤加入盐酸生成Al(OH)3沉淀 ⑥加入过量烧碱溶液
A.①⑥⑤③ B.②③④③
C.②③⑤③ D.①③⑤③
查看答案和解析>>
科目:高中化学 来源: 题型:
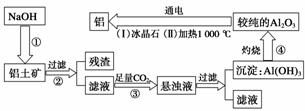
铝是地壳中含量最多的金属元素,在自然界主要以化合态形式存在于氧化铝中。铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质,冶炼金属铝很重要的一个过程是Al2O3的提纯。由于Al2O3是两性氧化物,而杂质SiO2是酸性氧化物,Fe2O3是碱性氧化物,因而可设计出两 种提纯氧化铝的方案。
种提纯氧化铝的方案。
方案一:碱溶法
讨论回答下列问题:
(1)写出①、③两步骤中可能发生反应的 离子方程式。
离子方程式。
查看答案和解析>>
科目:高中化学 来源: 题型:
近年来,科学家正在探索利用铝粉作为新能源的可能性,以期铝能成为一种石油的取代物。假如铝作为一种普遍使用的新型能源被开发利用,关于其有利因素的下列说法,你认为哪项是错误的 ( )
A.铝质轻,便于运输、贮存,且安全
B.铝燃烧时放出的热量大,且燃烧后产物对环境的污染容易得到有效的控制
C.在地球上,铝矿资源比较丰富
D.现代电冶铝的工业技术已为铝作为新能源奠定了重要基础
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )

图1 图2 图3
A.按系统命名法命名时, 图1的名称是3,5,7-三甲基-6-乙基辛烷
B.有机物( 图2)的一种芳香族同分异构体能发生银镜反应
C.等质量的乙酸甲酯和甲酸乙酯完全燃烧生成水的量相等
D.高分子化合物( 图3),其单体为对苯二甲酸和乙醇
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com