
【题目】汽车尾气中CO、NO2在一定条件下可以发生反应:4CO(g)+2NO2(g) ![]() 4CO2(g)+N2(g)ΔH=-1 200 kJ·mol-1。在一定温度下,向容积固定为2 L的密闭容器中充入一定量的CO和NO2,NO2的物质的量浓度随时间的变化曲线如图所示:
4CO2(g)+N2(g)ΔH=-1 200 kJ·mol-1。在一定温度下,向容积固定为2 L的密闭容器中充入一定量的CO和NO2,NO2的物质的量浓度随时间的变化曲线如图所示:

(1)0~10 min内该反应的平均速率v(CO)=________,从11 min起其他条件不变,压缩容器的容积变为1 L,则c(NO2)的变化曲线可能为图中的________(填字母)。
(2)恒温恒容条件下,不能说明该反应已达到平衡状态的是________(填字母)。
A.容器内混合气体颜色不再变化
B.容器内的压强保持不变
C.2v逆(NO2)=v正(N2)
D.容器内混合气体密度保持不变
(3)写出该反应平衡常数表达式:______,增大压强平衡______(填“正向”“不”“逆向”)移动,平衡常数______(填“增大”“减小”“不变”)。
(4)对于该反应,温度不同(T2>T1)、其他条件相同时,下列图像表示正确的是_______(填序号)。

【答案】0.06mol·L-1·min-1 b CD K=c4(CO2)c(N2)/c4(CO)c(NO2) 正向 不变 乙
【解析】
(1)由方程式的系数可知:V(CO)=2V(NO2)=2×![]() =0.06 mol·L-1·min-1; 从11min起其它条件不变,压缩容器的体积为1L,压强增大,平衡正向进行,压缩瞬间NO2物质的量不变,其浓度变为原来的2倍,随平衡正向进行,NO2物质的量浓度减小,b曲线符合c(NO2)的变化趋势;故答案为:0.06mol·L-1·min-1;b ;
=0.06 mol·L-1·min-1; 从11min起其它条件不变,压缩容器的体积为1L,压强增大,平衡正向进行,压缩瞬间NO2物质的量不变,其浓度变为原来的2倍,随平衡正向进行,NO2物质的量浓度减小,b曲线符合c(NO2)的变化趋势;故答案为:0.06mol·L-1·min-1;b ;
(2)A.容器内混合气体颜色不再变化,说明二氧化氮的浓度不变,反应达平衡状态;
B.容器内的压强保持不变,说明气体的物质的量不变,反应达平衡状态;
C.当v逆(NO2)=2v正(N2)时,能说明正逆反应速率相等;而2v逆(NO2)=v正(N2)时,可逆反应的正逆反应速率并不相等 ,反应此时未达平衡状态;
D.在恒容条件下容器内混合气体密度并不随反应的进行而发生改变,则容器内混合气体的密度不变并不能说明反应处于平衡状态;
故答案为:CD;
(3)由平衡常数的定义式可得该反应平衡常数的表达式为:K=c4(CO2)·c(N2)/c4(CO)·c(NO2);增大压强平衡向气体分子数目减小的方向发生移动,则平衡向正反应方向移动;温度不变,平衡常数不变,故此时平衡常数不变;故答案为:c4(CO2)·c(N2)/c4(CO)·c(NO2);正向;不变;
(4)甲.该反应为放热反应,升高温度,正逆反应速率均增大,都应该离开原来的速率点,图象与实际情况不相符,图甲错误;乙.升高温度,反应逆向进行,反应物的转化率减小,反应速率加快,图象与实际反应一致,图乙正确;丙.压强相同时,升高温度,反应逆向移动,一氧化碳的体积分数应该增大,且一氧化碳的体积分数随压强的增大应逐渐减小,图象丙与此不符,图丙错误;故答案为:乙;


科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 洗净的锥形瓶和容量瓶可以放进烘箱中烘干
B. 容量瓶、量筒上都标有使用温度,都无“0”刻度,用量筒量取完液体后需洗涤残留在内壁上的液体并与刚量完的液体合并
C. 金属汞一旦洒落在实验室地面或桌面时,必须尽可能收集,并深埋处理
D. 用容量瓶配溶液时,若加水超过刻度线,立即倒掉重配
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜(CuCl)可用作催化剂、杀菌剂、媒染剂、脱色剂。CuCl是一种白色粉末,微溶于水、不溶于乙醇,在潮湿的空气中易被氧化。实验室采用如图装置和下列步骤制备氯化亚铜。
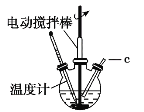
步骤1:在三颈烧瓶中加入20%盐酸、食盐、铜屑,加热至60~70℃,开动搅拌器,同时从c口缓慢通入氧气,制得Na[CuCl2]溶液。
步骤2:反应完全后,冷却,过滤,滤液用适量的水稀释,析出CuCl。
步骤3:过滤,分别用盐酸、乙醇洗涤滤出的固体。
步骤4:在真空干燥器中60~70 ℃干燥2h,冷却后得到产品。
回答下列问题:
(1)质量分数为20%的盐酸密度为1.1g/cm3,物质的量浓度为___________;配制20%盐酸需要的玻璃仪器有:__________、烧杯、玻璃棒、胶头滴管。
(2)步骤1中制得Na[CuCl2]的化学方程式为________________________________。
(3)根据“步骤2中用水稀释滤液能得到CuCl”推测,滤液中存在的平衡是____________。
(4)析出的CuCl晶体不用水而用盐酸、乙醇分别洗涤的目的是__________________。
(5)测定产品中氯化亚铜的质量分数,实验过程如下:
准确称取制备的氯化亚铜产品0.25 g,将其置于足量的FeCl3溶液中,待样品全部溶解后,加入适量稀硫酸,用0.10 mol/L的硫酸铈[Ce(SO4)2]标准溶液滴定到终点,消耗硫酸铈溶液24.50 mL,反应中Ce4+被还原为Ce3+。(已知:CuCl+FeCl3=CuCl2+FeCl2)
①硫酸铈标准溶液应盛放在________(填“酸”或“碱”)式滴定管中。
②产品中氯化亚铜的质量分数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了清理路面积雪,人们常使用一种融雪剂,其主要成分的化学式为XY2,X、Y均为周期表前20号元素,其阳离子和阴离子的电子层结构相同,且1 mol XY2含有54mol电子。
(1)该融雪剂的化学式是____,该物质中化学键类型是______,电子式是______。
(2)元素D、E原子的最外层电子数是其电子层数的2倍,D与Y相邻,则D的离子结构示意图是__________;D与E能形成一种结构类似于CO2的三原子分子,且每个原子均达到了8e-稳定结构,该分子的结构式为_________,电子式为_______,化学键类型为_________(填“离子键”“非极性共价键”或“极性共价键”)。
(3)W是与D同主族的短周期元素,Z是第三周期金属性最强的元素,Z的单质在W的常见单质中反应时有两种产物:不加热时生成____,其化学键类型为___;加热时生成_____,其化学键类型为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】AOH为弱碱,已知:2AOH(aq)+H2SO4(aq)===A2SO4(aq)+2H2O(l) ΔH1=-24.2 kJ·mol-1;H+(aq)+OH-(aq)===H2O(l) ΔH2=-57.3 kJ·mol-1。则AOH在水溶液中电离的ΔH为( )
A. +33.1 kJ·mol-1 B. +45.2 kJ·mol-1 C. -81.5 kJ·mol-1 D. -33.1 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有H+浓度均为0.1mol/L的醋酸甲和盐酸乙:
(1)请写出醋酸的电离常数的表达式:_____。
(2)取10 mL的甲溶液,加入等体积的水,醋酸的电离平衡__________(填“向左”、“向右”或“不”)移动,若加入少量的冰醋酸,醋酸的电离平衡________(填“向左”、“向右”或“不”)移动,若加入少量无水醋酸钠固体,待固体溶解后,溶液中c(H+)/c(CH3COOH)的值将________(填“增大”、“减小”或“无法确定”)。
(3)相同条件下,取等体积的甲、乙两溶液,加入足量的金属镁,开始反应时的速率:甲___乙(填“大于”、“小于”或“等于”)。产生氢气的体积:甲___乙(填“大于”、“小于”或“等于”)。
(4)0.1mol/L的甲溶液和0.05mol/L的甲溶液中氢离子浓度:前者是后者的_____。
A.小于2倍 B. 大于2倍 C. 等于2倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向体积为2 L的固定密闭容器中通入2mol X气体,在一定温度下发生如下反应:2X(g) ![]() Y(g)+3Z(g)ΔH=+92.0kJ· mol-1。经5 min 后反应达到平衡,此时测得容器内的压强为起始时的1.5倍。
Y(g)+3Z(g)ΔH=+92.0kJ· mol-1。经5 min 后反应达到平衡,此时测得容器内的压强为起始时的1.5倍。
(1)用Y表示的化学反应速率为_____,X的转化率为______,平衡时反应吸收的热量为_________。
(2)在定温,定容的条件下向平衡体系中再充入1mol X(g)气体,平衡______(填“正向”“不”“逆向”)移动, X(g)的转化率______(填“增大”“减小”“不变”),Y(g)的质量分数______(填“增大”“减小”“不变”)。
(3)在相同温度,相同容积的密闭容器中起始时充入0.8molX(g),0.6molY(g),1.8molZ(g),此时V正______V逆(填“大于”、“小于”或“等于”);平衡时X(g)的百分含量______ (填“大于”、“小于”或“等于”)原平衡。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电镀废水沉泥中含Cu、Ni、Ag和Fe等多种元素的有机金属盐,采用焙烧一浸出—分离回收的工艺流程可有效分离电镀废水沉泥中的金属,其流程如下:
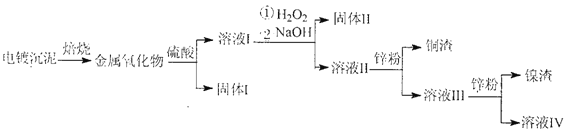
下列叙述错误的是
A. 上述流程中硫酸可以用稀盐酸代替
B. “固体Ⅱ”为Fe(OH)2
C. 溶液III中含有Na+、Ni2+、Zn2+等金属离子
D. 合理处理电镀废沉泥可实现资源的回收与可持续利用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家已经发明利用眼泪,检测糖尿病的装置,其原理是用氯金酸钠(NaAuCl4·2H2O)溶液与眼泪中的葡萄糖反应生成纳米金单质颗粒。下列有关说法不正确的是( )
A.葡萄糖不能发生水解反应
B.葡萄糖属于单糖
C.检测时NaAuCl4发生氧化反应
D.葡萄糖可以通过绿色植物的光合作用合成
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com