
| A. | NF3中只含有极性共价键 | |
| B. | NF3既是氧化产物,又是还原产物 | |
| C. | NH4F中既含有离子键又含有共价键 | |
| D. | 上述反应中,反应物和生成物均属于共价化合物 |
分析 4NH3+3F2=NF3+3NH4F中,N元素的化合价由-3价升高为+3价,F元素的化合价由0降低为-1,NH4F为离子化合物,含有离子键和共价键,以此来解答.
解答 解:A.NF3分子构型与NH3相似,NH3分子构型是三角锥型的,所以NF3分子为极性分子,故A正确;
B.NH3反应中N:-3-→+3,F:0-→-1,所以NF3既是氧化产物又是还原产物,故B正确;
C.NH4Cl与NH4F含的阳离子相同,阴离子是同一主族元素,所以NH4Cl与NH4F具有相同的化学键,所以NH4F中存在的化学键是离子键、极性共价键,故C正确;
D.NH4F是离子化合物,为离子晶体,故D错误.
故选D.
点评 本题考查物质的结构、化学键、物质的分类、氧化还原反应,该反应中元素的化合价的判断是解答的关键,并注意类推方法的应用,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
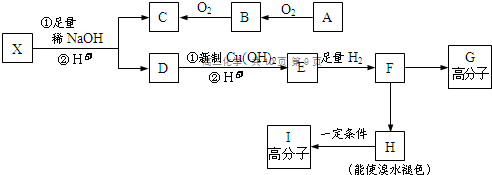
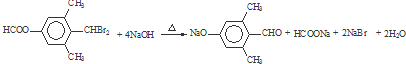
 →CH3-CHO+H2O
→CH3-CHO+H2O ;
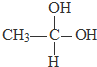
; ;
;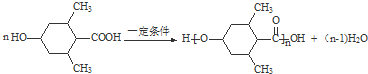 ;
;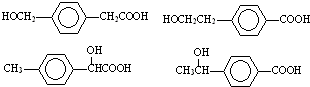 任意一种.
任意一种.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O+H2O?H3O++OH- | B. | CO32-+H2O?HCO3-+OH- | ||
| C. | CO2+H2O?H2CO3 | D. | HCO3-+H2O?CO32-+H3+O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 周期 族 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 1 | |||||||
| 2 | ① | ② | ③ | ||||
| 3 | ④ | ⑤ | ⑥ | ||||
 ,元素③和⑤对应的氢化物较稳定的是H2O(写化学式,下同),元素②和⑥对应最高价氧化物的水化物酸性较强的是HClO4.
,元素③和⑤对应的氢化物较稳定的是H2O(写化学式,下同),元素②和⑥对应最高价氧化物的水化物酸性较强的是HClO4.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
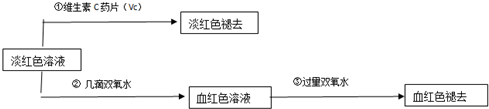
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2的摩尔质量为60 | |
| B. | 标况下,15gSiO2的体积为5.6L | |
| C. | SiO2 中Si 和 O的质量比为7:8 | |
| D. | 相同质量的SiO2 和CO2中所含O原子的数目相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 如图是某同学设计的放热反应的观察装置,其实验操作步骤如下①按图所示将实验装置连接好;②在U形管内加入少量红墨水(或品红溶液),打开T形管活塞,使U形管内两边的液面处于同一水平面,再关闭T形管活塞;③在盛有1g氧化钙的小试管里滴入2mL左右的蒸馏水,观察现象.
如图是某同学设计的放热反应的观察装置,其实验操作步骤如下①按图所示将实验装置连接好;②在U形管内加入少量红墨水(或品红溶液),打开T形管活塞,使U形管内两边的液面处于同一水平面,再关闭T形管活塞;③在盛有1g氧化钙的小试管里滴入2mL左右的蒸馏水,观察现象.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
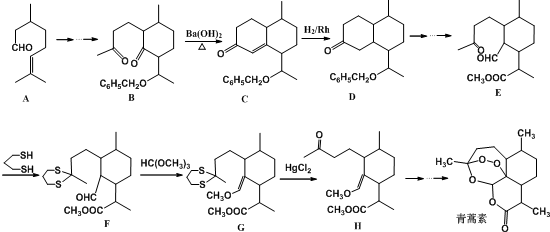
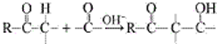
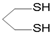 用系统命名法命名,它的名称是1,3-丙二硫醇;
用系统命名法命名,它的名称是1,3-丙二硫醇;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com