
| A、2.3gNa与一定量氧气发生反应,钠无剩余,则转移电子数一定为0.1NA |
| B、常温常压下,100g17%H2O2水溶液中含氧原子总数为NA |
| C、常温常压下,2.24LN2气体分子中所含的共用电子对数目为0.3NA |
| D、5.6Fe分别足量氯气、盐酸反应,转移电子数都是0.2NA |
| m |
| M |
| 2.3g |
| 23g/mol |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子半径:X>W>Y>Z |
| B、热稳定性:H2Y>HZ |
| C、离子半径:Y2->W2+ |
| D、碱性:W(OH)2>XOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,0.1monCl2与足量NaOH溶液反应,转移的电子数目为0.2NA |
| B、常温常压下,46g的NO2和N2O4混合气体含有的原子数为3NA |
| C、常温常压下,18gH2O2中含有的电子总数为10NA |
| D、标准状况下,22.4L CCl4含有的分子数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 第二周期中碳、氮、氧是构成生命物质的三种主要元素,在生产生活中也有着重要的应用.
第二周期中碳、氮、氧是构成生命物质的三种主要元素,在生产生活中也有着重要的应用.查看答案和解析>>
科目:高中化学 来源: 题型:
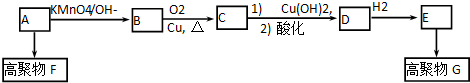
| KMnO4/OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、实验室使用电器时,不能用湿手接触电器 |
| B、实验结束后,应关好水龙头、排气扇及切断电源 |
| C、未经老师允许,可以带食物进实验室,可以边做实验边吃东西 |
| D、酒精灯里的酒精不准带出实验室 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com