
【题目】A、B、C、D 4种元素,其中A、B、C为短周期元素,A元素所处的周期数、主族序数、原子序数均相等;B的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层少2个;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C。
(1)B元素周期表中的位置是__________。
(2)画出C的阴离子的结构示意图:__________。
(3)A的单质与B的单质在一定条件下反应的化学方程式:__________。
(4)C的最高价氧化物的化学式:__________。
(5)由A、B 、C 三种元素组成的离子化合物的化学式:__________。
(6)C最高价氧化物的水化物的水溶液与D最高价氧化物的水化物的水溶液相互反应的离子方程式是__________。
【答案】 第二周期第VA族 略 N2+3H2![]() 2NH3 SO (NH4)2S或NH4HS H++OH-=H2O
2NH3 SO (NH4)2S或NH4HS H++OH-=H2O
【解析】A、B、C、D四种元素,A元素所处的周期数、主族序数、原子序数均相等,则A为H元素;B的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3,则B为N元素;C元素原子的最外层电子数比次外层少2个,则C应有三个电子层,最外层电子数为6,即C为S元素;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C,D在第四周期第ⅠA族,即D为K;
(1)由上述推断可知,B为氮元素,原子序数为7,处于周期表中第二周期第ⅤA族;
(2)S2-离子的结构示意图为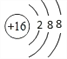 ;
;
(3)在一定条件下合成氨反应的化学方程式为N2+3H2![]() 2NH3;
2NH3;
(4)由上述推断可知,C为S元素,S的最高价为+6价,则最高价氧化物为SO3,;
(5)由H、N 、S三种元素组成的离子化合物的化学式为(NH4)2S或NH4HS;
(6)稀硫酸与KOH溶液发生中和反应的离子方程式是H++OH-=H2O。


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:
【题目】李时珍在《本草纲目》中记载小米“健脾、和胃、安眠”。现代医学认为:小米的安神作用与其中含有某种氨基酸有关。下列有机物能水解生成氨基酸的是
A. 油脂 B. 蛋白质 C. 淀粉 D. 纤维素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于过氧化钠的性质和用途的描述正确的是
A. 过氧化钠是一种淡黄色固体,性质非常活泼
B. 过氧化钠需要密封保存是因为它能与空气中的所有成分反应
C. 过氧化钠与二氧化碳的反应很慢,且该反应吸热
D. 过氧化钠属于碱性氧化物,能与酸反应生成盐和水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组分子中的各个原子,或者处于同一平面,或者在一条直线上的是( )
A.CO2,HCl,HC≡CCH3
B.C6H6,C2H4,CO2
C.C6H6,HCl,CH4
D.C2H6,HCl,C2H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业合成氨的反应为:N2(g) + 3H 2(g) ![]() 2NH3(g); △H<0
2NH3(g); △H<0
(1)、随着温度升高,平衡常数K值变_______。
(2)改变反应条件,会使平衡发生移动。如下图像表示随条件改变,氨气的百分含量的变化趋势。

当横坐标为压强时,变化趋势正确的是(选填字母序号)_________,
当横坐标为温度时,变化趋势正确的是(选填字母序号)__________。
(3)如图所示三个容积相同的容器①、②、③,若起始温度相同,分别向三个容器中充入①中3mol H2和1mol N2;②中2mol NH3;③中1.5mol H2和0.5mol N2和1mol NH3;一定条件下反应,达到平衡时各容器中NH3物质的百分含量由大到小的顺序为_____(填容器编号)。

(4)氨气和氧气从145℃就开始反应,在不同温度和催化剂条件下生成不同产物(如图所示):

4NH3+5O24NO+6H2O 4NH3+3O22N2+6H2O 温度高于900℃时,NO产率下降的原因_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质性质的叙述中,正确的是( )
A.Cl2能与金属活动顺序表中大多数金属反应
B.N2是大气中的主要成分之一,雷雨时,可直接转化为NO2
C.硫是一种淡黄色的能溶于水的晶体,既有氧化性又有还原性
D.硅是应用广泛的半导体材料,常温下化学性质活泼
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是元素周期表的一部分,针对表中的①~⑩中元素,填写下列空格:
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
二 | ① | ② | ③ | |||||
三 | ⑥ | ④ | ⑤ | ⑦ | ⑩ | ⑧ | ⑨ |
⑴在这10种元素中,非金属性最强的元素是_____ (填“元素符号”);金属性最强的元素是_____(填“元素符号”);化学性质最不活泼的元素是_______(填“元素符号”);元素②简单离子的结构示意图为___________________。
⑵元素①与②中,原子半径较大的是________(填元素符号)。
⑶元素②与⑦的气态氢化物分别为__________和__________ (填化学式),两者的热稳定性大小为:前者_____后者。(填“>”、“<”或“=”)。
⑷元素④与⑧的最高价氧化物的水化物分别为______和______(填“化学式”),
两者反应的离子方程式为__________________________________。
⑸元素⑤的氧化物与盐酸反应的离子方程式为: _______________________。
⑹元素⑧的单质与元素⑩的氢化物反应的化学方程式为:__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com