


科目:高中化学 来源:2013-2014学年上海市闵行区高三上学期期末教学质量检测化学试卷(解析版) 题型:选择题
已知H2S能定量完成下列反应:R- +H2S(少量) HR + HS-,
2Z-+ H2S(少量)
HR + HS-,
2Z-+ H2S(少量) 2HZ + S2-。下列叙述正确的是
2HZ + S2-。下列叙述正确的是
A.相同温度下电离平衡常数:Ki1(H2S)>Ki(HZ)>Ki2(H2S)>Ki(HR)
B.结合H+的能力:Z->S 2->R->HS-
C.同温同浓度下,溶液的pH值:NaHS>NaR>Na2S>NaZ
D.HZ与Na2S反应的离子方程式:HZ +S2- HS- + Z-
HS- + Z-
查看答案和解析>>
科目:高中化学 来源:浙江省模拟题 题型:实验题
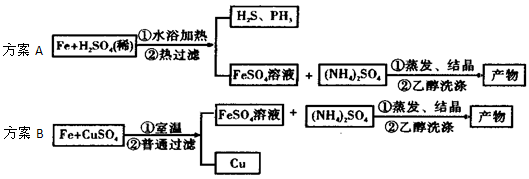


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com