
如图为相互串联的甲乙两电解池
试回答:
(1)甲池若为用电解原理精炼铜的装置,则B是 极,材料是 ,A电极反应为 。
(2)乙池中若滴入少量石蕊试液,电解一段时间后Fe极附近呈 色.
(3)若甲池为电解精炼铜,阴极增重6.4g,则:乙池中阳极放出的气体在标准状况下的体积为 ;若此时乙池剩余液体为400 mL,则电解后得到碱液的物质的量浓度为 。
(6分)(1)阳极;粗铜;Cu2++2 e-=Cu ;(2)蓝;(3)2.24L;0.5mol/L
解析试题分析:(1)甲池中A电极和电源的负极相连,做阴极,B是阳极。甲池若为用电解原理精炼铜的装置,则B是连接粗铜,做阳极。A连接纯铜,溶液中的铜离子放电,电极反应式是Cu2++2 e-=Cu。
(2)乙池中碳棒和电源的正极相连,做阳极,溶液中的氯离子放电生成氯气。铁电极是阴极,溶液中的氢离子放电,生成氢气,所以铁电极周围水的电离平衡被破坏,溶液显碱性,所以电解一段时间后Fe极附近呈蓝色。
(3)若甲池为电解精炼铜,阴极增重6.4g,即析出的铜是6.4g,物质的量是0.1mol,转移0.2mol电子。则根据电子的得失守恒可知,乙池中生成氯气的物质的量是0.2mol÷2=0.1mol,在标准状况下的体积是2.24L。根据反应式2NaCl+2H2O 2NaOH+H2↑+Cl2↑可知,生成的氢氧化钠是0.2mol,物质的量浓度是0.2mol÷0.4L=0.5mol/L。
2NaOH+H2↑+Cl2↑可知,生成的氢氧化钠是0.2mol,物质的量浓度是0.2mol÷0.4L=0.5mol/L。
考点:考查粗铜的精炼、电解原理的应用、判断和计算
点评:该题是中等难度的试题,试题贴近高考,基础性强,侧重对学生能力的培养。该题的关键是明确电解池的工作原理,特别是电极名称、电极反应式的书写等,有利于培养学生的逻辑推理能力和发散思维能力。


科目:高中化学 来源: 题型:填空题
钠及其化合物具有广泛的用途。 (1)工业上可利用反应Na(1)+ KCl(1) K(g)+ NaCl(1)来治炼金属钾,此反应利用了钠的还原性及___ _____,
(1)工业上可利用反应Na(1)+ KCl(1) K(g)+ NaCl(1)来治炼金属钾,此反应利用了钠的还原性及___ _____,
写出钠与TiCl4反应冶炼Ti的化学方程式______________ _______。
(2)用Na2CO3熔融盐作电解质,CO、O2为原料组成的新型电池的研究取得了重大突破。该电池示意图如图:
负极电极反应式为________________,为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A物质参加循环。A物质的化学式为______________。
(3)Li-SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是
LiAlCl4-SOCl2。电池的总反应可表示为: 4Li + 2SOCl2 =4LiCl + S + SO2。
请回答下列问题:
①电池的负极材料为 ,发生的电极反应为 ;
②电池正极发生的电极反应为 ;
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某厂废水中含量金属Cr3+(含有少量Fe3+、Cu2+)。某研究性学习小组为了变废为宝,将废水处理得到重铬酸钾。某含铬废水处理的主要流程如图所示:
已知:① 沉淀完全,而在pH≥3.2时
沉淀完全,而在pH≥3.2时
Fe(OH)3沉淀完全。
②CrO2—4在酸性环境中发生:
回答下列问题:
(1)滤渣的成分是 。(写化学式)
(2)写出第③步反应的离子方程式 。
(3)分离出含[Cr(OH)4]—的溶液需要的玻璃仪器有 。
(4)目前一种采用以铬酸钾为原料,电化学法制备重要铬酸钾的实验装置示意图如下:
电解一段时间后,测定阳极液中K元素和Cr元素的含量,若K元素与Cr元素的物质的量之比 为d,则此时的铬酸钾的转化率为 。
为d,则此时的铬酸钾的转化率为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
根据组成原电池的条件,试以反应:Fe+Cu2+=Fe2++Cu设计一个原电池,画出示意图并标出原电池的正、负极和电子的流向(画在下面方框中),写出电极反应式。
供选用的电解质溶液有:稀硫酸、硫酸铜溶液、氯化铜溶液。
供选用的电极材料有:锌片、铜片、铁片、石墨。
电极材料及电极反应式:
负极材料: ,电极反应式:
正极材料: ,电极反应式:
电解质溶液: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。
(1) A中反应的离子方程式为 。
(2)B中Sn极的电极反应式为 。Sn极附近溶液的c (填 “变大”“变小”或“不变”)。
(填 “变大”“变小”或“不变”)。
(3)C中被腐蚀的金属是 ,总反应的化学方程式为
,比较A、B、C中铁被腐蚀的速率,由快到慢的顺序为 (填序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
(6分)由Zn—Cu—H2SO4组成的原电池,工作一段时间后,锌片的质量减少了6.5g。求:
(1)原电池生成氢气_______L(标准状况)。
(2)已知:1mol氢气完全燃烧放出285.8kJ的热量。将(1)中获得的氢气燃烧,可以得到_________kJ的热量。
(3)若起始时刻两电极质量相等,将电解质溶液改为硫酸铜溶液,当电池输出相同的电量时,电池两极的质量差为__________g。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
【选修2化学与技术】(15分)
由黄铜矿(主要成分是CuFeS2)炼制精铜的工艺流程示意图如下: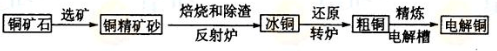
(1)在反射炉中,把铜精矿砂和石英砂混合加热到1000℃左右,黄铜矿与空气反应
生成Cu和Fe的低价硫化物,且部分Fe的硫化物转变为低价氧化物。该过程中两个主
要反应的化学方程式分别是 、
,反射炉内生成炉渣的主要成分是 ;
(2)冰铜(Cu2S和FeS互相熔合而成)含Cu量为20%--50%。转炉中,将冰铜加
熔剂(石英砂)在1200℃左右吹入空气进行吹炼。冰铜中的Cu2S被氧化为Cu2O,生成Cu2O与Cu2S反应,生成含Cu量约为98.5%的粗铜,该过程发生反应的化学方程式分别是 、 ;
(3)粗铜的电解精炼如右图所示。在粗铜的电解过程中,粗铜板应是图中电极_ _(填图中的字母);在电极d上发生的电极反应式为 ;若粗铜中还含有Au、Ag、Fe,它们在电解槽中的存在形式和位置为 。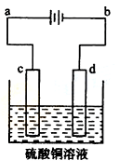
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com