
【题目】室温下,用0.20mol/L的NaOH溶液滴定10.00mL0.20mol/L的NaHSO3溶液,滴定过程中溶液的pH变化和滴加NaOH溶液的体积关系如图所示。下列说法错误的是( )
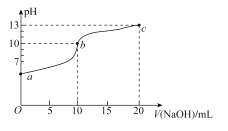
A.溶液中水的电离程度:b>a>c
B.pH=7时,消耗的V(NaOH)<10.00mL
C.在室温下K2(H2SO3)约为1.0×10-7
D.c点溶液中c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+)
【答案】D
【解析】
A.b的溶质为亚硫酸钠,亚硫酸钠水解会促进水的电离,a的溶质为NaHSO3,电离大于水解会抑制水的电离,c的主要溶质是NaOH和亚硫酸钠,pH=13,对水的电离抑制作用最大,A项正确;
B.当NaHSO3与氢氧化钠恰好完全反应时,形成亚硫酸钠溶液,亚硫酸钠水解使溶液pH>7,所以pH =7时,滴定亚硫酸消耗的V(NaOH)<10.00mL,B项正确;
C.b的溶质为0.1mol/L亚硫酸钠,亚硫酸钠水解为HSO3-和OH-,Kh=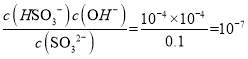 ,Kh=
,Kh=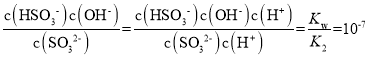 ,解得K2(H2SO3)约为1.0×10-7,C项正确;
,解得K2(H2SO3)约为1.0×10-7,C项正确;
D.c的主要溶质是NaOH和亚硫酸钠,应为c(OH-)>c(SO32-),D项错误;
答案选D。


科目:高中化学 来源: 题型:
【题目】工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大危害,必须进行处理.常用的处理方法有两种.方法1:还原沉淀法.
该法的工艺流程为:
其中第①步存在平衡2CrO42(黄色)+2H+Cr2O32(橙色)+H2O
(1)若平衡体系的pH=2,该溶液显______色.
(2)能说明第①步反应达平衡状态的是_____(填序号)
A.Cr2O72和CrO42的浓度相同
B.2v(Cr2O72)=v(CrO42)
C.溶液的颜色不变
(3)第②步中,还原1molCr2O72离子,需要______mol的FeSO47H2O.
(4)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至______.
方法2:电解法.
该法用Fe做电极电解含Cr2O72的酸性废水,随着电解的进行,在阴极附近溶液pH升高,产生
Cr(OH)3沉淀.
(5)用Fe做电极的原因为______(用电极反应式解释).
(6)在阴极附近溶液pH升高,溶液中同时生成的沉淀还有______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯是高效、低毒的消毒剂。已知:ClO2是极易溶于水的气体,实验室制备及性质探究装置如图所示。回答下列问题:
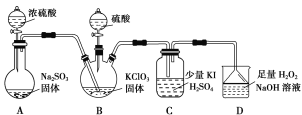
(1)装置B用于制备ClO2,同时还生成一种酸式盐,该反应的化学方程式为___________。装置C中滴有几滴淀粉溶液,反应时有蓝色岀现。淀粉的作用是______。
(2)装置C的导管靠近而不接触液面,其目的是________。
(3)用ClO2消毒自来水,其效果是同质量氯气的______倍(保留一位小数)。
(4)装置D用于吸收尾气,若反应的氧化产物是一种单质,且氧化剂与氧化产物的物质的量之比是2∶1,则还原产物的化学式是___________。
(5)若将装置C中的溶液改为Na2S溶液,通入ClO2后溶液无明显现象。由此可以产生两种假设:
假设a:ClO2与Na2S不反应。
假设b:ClO2与Na2S反应。
①你认为哪种假设正确,阐述原因:___________。
②请设计实验证明你的假设(仅用离子方程式表示):__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用间接酸碱滴定法可测定Ba2+的含量,实验分两步进行。
已知:2CrO![]() +2H+===Cr2O
+2H+===Cr2O![]() +H2O Ba2++CrO
+H2O Ba2++CrO![]() ===BaCrO4↓
===BaCrO4↓
步骤Ⅰ移取x mL一定浓度的Na2CrO4溶液于锥形瓶中,加入酸碱指示剂,用b mol·L-1盐酸标准液滴定至终点,测得滴加盐酸体积为V0 mL。
步骤Ⅱ:移取y mL BaCl2溶液于锥形瓶中,加入x mL与步骤Ⅰ相同浓度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸碱指示剂,用b mol·L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1mL。滴加盐酸标准液时应用酸式滴定管,“0”刻度位于滴定管的________(填“上方”或“下方”)。BaCl2溶液的浓度为________mol·L-1,若步骤Ⅱ中滴加盐酸时有少量待测液溅出,Ba2+浓度测量值将________(填“偏大”或“偏小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将①H+、②Cl-、③Al3+、④K+、⑤S2-、⑥OH-、⑦NO3-、⑧NH4+分别加入H2O中,基本上不影响水的电离平衡的离子是( )
A.①③⑤⑦⑧B.②④⑥⑧C.①⑥D.②④⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(NaNO2)外观酷似食盐且有咸味,是一种常用的防腐剂。某化学兴趣小组设计如图所示装置(省略夹持装置)制备NaNO2并探究其性质。
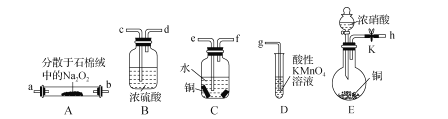
已知:①2NO+Na2O2=2NaNO2;
②NaNO2易被空气氧化,NO能被酸性高锰酸钾溶液氧化为NO3-;
③HNO2为弱酸,室温下存在反应3HNO2=HNO3+2NO+H2O。
回答下列问题:
(1)装置E中盛放铜片的仪器名称是_____,检査装置E气密性的方法是_____。
(2)上述实验装置中,依次连接的合理顺序为h-_____。
(3)装置D中酸性KMnO4溶液的作用是_____(用离子方程式表示)。
(4)反应结束后,取适量产品溶于稀硫酸中,观察到的实验现象为_____。
(5)测定深水井中亚硝酸钠含量:取1000mL水样于锥形瓶中,立即加入50.00mL0.001mol/L酸性高锰酸钾溶液,充分反应后用0.001mol·L-1草酸钠溶液滴定剩余的高锰酸钾,终点时消耗草酸钠溶液115.00mL。则水中NaNO2的含量为_____mg·L-1。若所取样品在空气中放置时间过长,则测定结果_____(填“偏高”“偏低”或“无影响”)。
有关反应如下:
5NO2-+2MnO4-+6H+=5NO3-+2Mn2++3H2O;5C2O42-+2MnO4-+16H+=2Mn2++10CO2↑+8H2O。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中各微粒的浓度关系正确的是
A.0.1 mol·L-1NaHSO4溶液中:c(Na+)>c(SO42-)>c(H+) >c(OH-)
B.0.1 mol·L-1Na2S溶液中:2 c(Na+)=c(S2-)+c(HS-)+c(H2S)
C.0.1 mol·L-1NaHCO3溶液中:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-)
D.等体积、等物质的量浓度的乙酸溶液和氢氧化钠溶液混合后:C(Na+)=c(CH3COO-)>c(H+)=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微量元素硼对植物的生长和人体骨骼的健康有着十分重要的作用。请回答下列问題:
(1)区分晶体硼和无定硼形科学的方法为_________________________________。
(2)下列B原子基态的价层电子排布图中正确的是___________
A.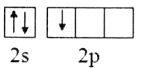 B.
B.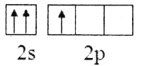
C.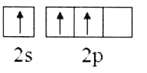 D.
D.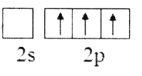
(3)NaBH4是重要的储氢载体,阴离子的立体构型为___________。
(4)三硫化四磷分子(结构如下图1所示)是___________分子(填极性”或非极性)。
(5)图2表示多硼酸根离子的一种无限长的链式结构,其化学式可表示为___________。
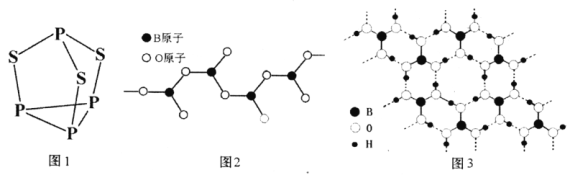
(6)硼酸晶体是片层结构,其中一层的结构如图3所示。硼酸在冷水中溶解度很小,但在热水中较大,原因是_________________________________。
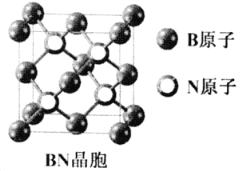
(7)立方氮化硼(BN)是新型高强度耐磨材料,可作为金属表面的保护层,其晶胞结构(如右图)与金刚石类似。已知该晶体密度为ag/cm3,则晶体中两个N原子间的最小距离为___________pm。(用含a的代数式表示,NA表示阿伏加德罗常数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】连二次硝酸(H2N2O2)是一种二元酸。常温下,向10 mL 0.01 mol·L-1的H2N2O2溶液中滴加0.01 mol·L-1的NaOH溶液,测得H2N2O2溶液pH与NaOH溶液体积的关系如图所示。下列说法不正确的是

A.由a点到n点水的电离程度依次增大
B.a点时,c(H2N2O2)>c(Na+)
C.m点时,c(OH-)+c(N2O22-)=c(H2N2O2)+c(H+)
D.m点到n点,![]() 比值不变
比值不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com