
| A.Na | B.Mg | C.Ag | D.Fe |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题
| A.可用蒸馏或离子交换等方法淡化海水 |
| B.海水提溴只涉及物理变化 |
| C.利用海水可以制取金属Mg |
| D.开发海洋资源不能以牺牲环境为代价 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
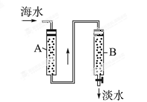
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
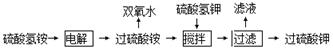

查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
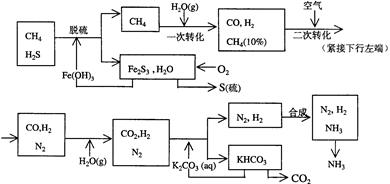
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.制钠:用海水为原料制得精盐,再电解纯净的NaCl溶液 |
| B.制铁:以铁矿石为原料,CO还原得铁 |
| C.制镁:用海水为原料,经一系列过程制得氧化镁固体,H2还原得镁 |
| D.制铝:从铝土矿中获得氧化铝再得到氯化铝固体,电解熔融的氯化铝得到铝 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
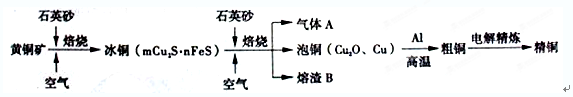
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
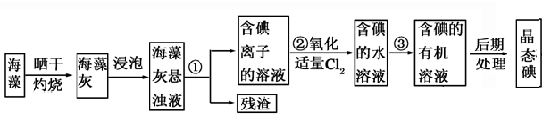
| A.甲苯,酒精 | B.四氯化碳,苯 | C.汽油,乙酸 | D.汽油,乙二醇 |
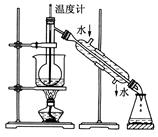
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 4CO(g) + SrS(s) △H=+a kJ·mol-1
4CO(g) + SrS(s) △H=+a kJ·mol-1  2CO2(g) + SrS(s) △H=+b kJ·mol-1
2CO2(g) + SrS(s) △H=+b kJ·mol-1  2CO(g)的△H= ___________kJ·mol-1。
2CO(g)的△H= ___________kJ·mol-1。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com