
| A.Cu+稀HNO3 | B.Cu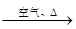 CuO CuO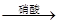 Cu(NO3)2 Cu(NO3)2 |
| C.Cu+浓HNO3 | D.Cu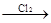 CuCl2 CuCl2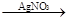 Cu(NO3)2 Cu(NO3)2 |
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.浓硝酸使紫色石蕊试液先变红后褪色——酸性和强氧化性 |
| B.不能用稀硝酸与锌反应制氢气——强氧化性 |
| C.要用棕色瓶盛装浓硝酸——不稳定性 |
| D.能使滴有酚酞的氢氧化钠溶液红色褪去——强氧化性 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
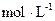 ,则c(H2)= ,20min内,用N2浓度的变化表示的反应速率为 。
,则c(H2)= ,20min内,用N2浓度的变化表示的反应速率为 。 )∶n(NH3)=1∶3∶2
)∶n(NH3)=1∶3∶2 SO4+2NH3+CO2+H2O= CaCO3+(NH4)2SO4
SO4+2NH3+CO2+H2O= CaCO3+(NH4)2SO4查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①②③ | B.①②④ | C.①③④ | D.②③④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
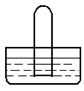
| A.若水槽中是水,试管中是Br2蒸气,可看到试管中液面并未有明显上升 |
| B.若水槽中是水,试管中是NO2,可看到试管中液面上升并充满整个试管 |
| C.若水槽中是水(并滴有一定量酚酞),试管中是NH3,可看到液面上升并呈红色 |
| D.若水槽中是水,试管中是NO,可看到试管中液面并未有明显上升 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.砷原子最外层有3个电子 | B.砷化氢(AsH3)比NH3稳定 |
| C.砷的+3价化合物有一定的还原性 | D.砷酸(H3AsO4)的酸性强于磷酸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 表示其原因 。
表示其原因 。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.a/b | B.a/2b | C.a/(a+2b) | D.a/2(a+b) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com