
(1)25 ℃时,0.1 mol·L-1NaOH溶液的pH为________;
(2)25 ℃时,0.1 mol·L-1NH4Cl溶液的pH_____7(填“<”、“=”或“>”),其原因是_________(用离子方程式表示);
(3)将上述两种溶液等体积混合后,离子浓度大小次序正确的是________(填序号)。
A.[Na+]>[Cl-]>[OH-]>[H+]
B.[Na+]=[Cl-]>[H+]>[OH-]
C.[Na+]=[Cl-]>[OH-]>[H+]
D.[Cl-]>[Na+]>[OH-]>[H+]
(4) 下列物质能导电且属于电解质的是________(填序号)。
A.铁 B.盐酸 C.氯化钠晶体 D.熔融氢氧化钠
(5) 25℃时,0.1 mol·L-1NaOH溶液中水电离出来的氢氧根的浓度为C1,0.1 mol·L-1NH4Cl溶液中水电离出来的氢离子的浓度为C2,则C1 ______C2(填“<”、“=”或“>”)。
(1)13 (2)< NH4++H2O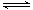 NH3·H2O+H+ (3)C (4) D (5) <
NH3·H2O+H+ (3)C (4) D (5) <
【解析】
试题分析:(1)氢氧化钠是一元强碱,则25 ℃时,0.1 mol·L-1NaOH溶液中OH-浓度是0.1mol/L,所以溶液中氢离子浓度=10-14÷0.1=10-13mol/,因此溶液的pH为13。
(2)由于氯化铵是强酸弱碱盐,溶于水NH4+水解,NH4++H2O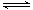 NH3·H2O+H+,溶液显酸性,则25 ℃时,0.1 mol·L-1NH4Cl溶液的pH<7。
NH3·H2O+H+,溶液显酸性,则25 ℃时,0.1 mol·L-1NH4Cl溶液的pH<7。
(3))25 ℃时,0.1 mol·L-1NaOH溶液与0.1 mol·L-1NH4Cl溶液等体积混合后,二者恰好反应生成氯化钠和弱电解质一水合氨,溶液显碱性,因此溶液中离子浓度大小关系是[Na+]=[Cl-]>[OH-]>[H+],答案选C。
(4)溶于水或在熔融状态下能够电离出离子的化合物是电解质,溶于水和在熔融状态下都不能电离出离子的化合物是非电解质,据此可以判断。A、铁是金属单质,可以导电,但不是电解质,也不是非电解质,A不正确;B、盐酸可以导电,但属于混合物,不是电解质,也不是非电解质,B不正确;C、氯化钠晶体是电解质,但不能导电,只有溶于水或在熔融状态下才能导电,C不正确;D、熔融的氢氧化钠可以导电,属于电解质,D正确,答案选D。
(5)水是弱电解质,存在电离平衡H2O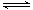 H++OH-。因此酸或碱抑制水的电离,盐类水解促进水的电离。0.1 mol·L-1NaOH溶液中水电离出来的氢氧根的浓度为C1,0.1 mol·L-1NH4Cl溶液中水电离出来的氢离子的浓度为C2,则C1<C2。
H++OH-。因此酸或碱抑制水的电离,盐类水解促进水的电离。0.1 mol·L-1NaOH溶液中水电离出来的氢氧根的浓度为C1,0.1 mol·L-1NH4Cl溶液中水电离出来的氢离子的浓度为C2,则C1<C2。
考点:考查pH计算、弱电解质的电离、盐类水解、电解质与导电性判断以及溶液中离子浓度大小比较


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2011-2012年广东省高二上学期期中考试化学(文)试卷 题型:选择题
当有人出现水杨酸反应(头痛、眩晕、恶心、耳鸣)时,医生可采取在静脉中注射下列哪种物质
A.1.25%NH4Cl B.0.9%NaHCO3 C.75%酒精 D.10%的青霉素
查看答案和解析>>
科目:高中化学 来源:2012-2013学年湖北省部分重点中学高二(上)期中化学试卷(解析版) 题型:选择题
查看答案和解析>>
科目:高中化学 来源:2011年广东省中山市高考化学模拟试卷(五)(解析版) 题型:选择题
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)25 °C时,0.1 mol·L-1NaOH溶液的pH为________;
(2)25 °C时,0.1 mol·L-1NH4Cl溶液的pH________7(填“<”、“=”或“>”),其原因是__________________________(用离子方程式表示);
(3)将上述两种溶液等体积混合后,离子浓度大小次序正确的是________(填序号)。
A.[Na+]>[Cl-]>[OH-]>[H+]
B.[Na+]=[Cl-]>[H+]>[OH-]
C.[Na+]=[Cl-]>[OH-]>[H+]
D.[Cl-]>[Na+]>[OH-]>[H+]
(4) 下列物质能导电且属于电解质的是________(填序号)。
A、铁 B 、盐酸 C 、氯化钠晶体 D 、熔融氢氧化钠
(5) )25 °C时,0.1 mol·L-1NaOH溶液中水电离出来的氢氧根的浓度为C1,0.1 mol·L-1NH4Cl溶液中水电离出来的氢离子的浓度为C2,
则C1 ______C2(填“<”、“=”或“>”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com