
��15�֣�����ʯ���ʵĸ���Ʒ����������(Na2SiF6)���Ʊ���ʯ(Na3AlF6)������ʯ�ǵ���������ۼ�,�ɽ������������۵㡣��ͼ�ǹ�ҵ����������ͼ��

��1����ҵ�ϴ��������Ʊ��ϸߴ���Al2O3����Ҫ����������__________�����ڣ���һ����Ӧ�ķ���ʽ______________________________________________________________
��2�����Ʊ������������ι��˲��������˲����ٵ���Һ��________��Һ��������________ ��
��3���ֽ��ѹ�ͺϳɱ���ʯ��ѧ��Ӧ����ʽ�ֱ�Ϊ��_________________��____________________��
��4�����չ����Тۺܵ͢�Ŀ����_____________________��̼���ƺͶ�����̼�Ƿ��� ��
��5�����Al2O3��Alʱ��I=200kA��һ����Al 1��430 t�����Ч���Ƕ��٣�
��1���� Al2O3+2NaOH=2NaAlO2+H2O
��2��NaF SiO2
��3��2Na2CO3+Na2SiF6=SiO2��+2CO2��+ 6NaF 6NaF +NaAlO2+2CO2=Na3AlF6��+2Na2CO3
��4��Na2CO3��CO2ѭ��ʹ�� �������ã�������ľ��貹��
��5��88��7%
��������
�����������1����ҵ�ϴ��������Ʊ��ϸߴ���Al2O3����Ҫ�������̣����ȼ�������NaOH��Һ��ʹAlת��ΪAlO2-,�������Һ�м���������������ᣬ��ʱAl��ΪAl3+��Ȼ����������İ�ˮ�õ�Al(OH)3������������˳�����ϴ�Ӹɾ�����ɡ��������Al(OH)3�õ�������Al2O3�������Ҫ�������ڡ���һ����Ӧ�ķ���ʽAl2O3+2NaOH=2NaAlO2+H2O����2�����Ʊ������������ι��˲�����������ͼ��֪���ڹ��˲����ٵ���Һ��NaF��������SiO2����3���ֽ��ѹ軯ѧ��Ӧ����ʽ��2Na2CO3+Na2SiF6=SiO2��+2CO2��+ 6NaF���ϳɱ���ʯ��ѧ��Ӧ����ʽ�ֱ�Ϊ��6NaF +NaAlO2+2CO2=Na3AlF6��+2Na2CO3 �� ��4�����չ����Тۺܵ͢�Ŀ����Na2CO3��CO2ѭ��ʹ�ã�������ʵ������ʡ����ܡ��������ɵ������ķ���ʽ��֪��������̼���ƺͶ�����̼ǡ����ȫ��Ӧ������ʵ��Ӧ��ʹ�������ʵ������ʲ�����100%�����Ծ��貹�䡣��5��һ����Al 1��430 t��n(e-)=1��430��106g��27g/mol��3=1��6��105mol������Q=1��6��105��6��02��1023��1��6��10-19=1��54��1010,���ĵĵ���n(e-)=2��105��3600��24=1��73��1010�����Ե��Ч���ǣ�1��54��1010��1��73��1010����100%=88��7%��
���㣺�������ʵ��Ʊ��������ķ��롢��ѧ����ʽ����д�����Ч�ʵ�֪ʶ��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2013-2014����ʡ����и߶���ѧ���������Ի�ѧ�Ծ��������棩 ���ͣ������
��10�֣�����ͼ��ʾ�������µ��5 min��ͭ�缫��������2.16g��
�Իش�
��1����Դ�缫X����Ϊ_______�������������������
��2������B�������ĵ缫��Ӧʽ��__________��
��3����A��KCl��Һ�������200mL��������Һ��
pH=_________�����Ե��ǰ����Һ����ı仯����
��Ҫʹ�������Һ�ָ�����������ȫ��ͬ��Ӧ�����������__________��
��4����֪��l0lkPaʱ��CO��ȼ����Ϊ283 kJ/mol����ͬ�����£���2 molCH4��ȫȼ������Һ̬ˮ�����ų�������Ϊ1 mol CO��ȫȼ�շų�������6.30������CH4��ȫȼ�յ��Ȼ�ѧ����ʽΪ__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014����ʡ����и�һ��ѧ���������Ի�ѧ��A�����Ծ��������棩 ���ͣ������
����������������2013��10��1�յ磺Լ19ʱ26�֣��϶���������ɹ����䡣����Щʱ������������9ʱ�𣬹�����Ա��ʼΪ���϶���š��ͳ����������ע����ȼ�ϣ���14ʱ30�����Ҽ�ע����ȼ�ռ�;�˺���18ʱ���Ҽ�ע��������
��֪��A��B��C��D��Ԫ�����ڱ��е����ֶ�����Ԫ�أ���ԭ��������������A�ĵ��������������еġ�ȼ�ռ�����C�ĵ��������������еġ�����������AԪ��ԭ����û�����ӣ�bB��cC����Ԫ�ش��ڹ�ϵ��b=c-l��CԪ�س������ϼ۵ľ���ֵ����������������ͬ����B��C���γɶ�����̬���������һ�ֿ����ڴ���Ȼ״̬���γɣ�A��D����Ԫ���γɵ�˫ԭ�ӷ��ӵ�ˮ��Һ�ǹ�ҵ����ǿ��֮һ�������������⣺
��1��AԪ����Ԫ�����ڱ���________���У�DԪ����Ԫ�����ڱ���________�����С�
��2��Bԭ�ӵ�ԭ�ӽṹʾ��ͼΪ________��
��3��A��B����Ԫ���γɵ���ԭ�ӷ��ӵĵ���ʽΪ________��
��4��A�ĵ�����C�ĵ��ʷ�����Ӧ�Ļ�ѧ����ʽΪ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014����ʡ����и�һ��ѧ���������Ի�ѧ��A�����Ծ��������棩 ���ͣ�ѡ����
������ɫ��Һ�д��������һ��������
A��Cu2+��SO42����OH����K+ B��Fe3+��Cl����NO3����H+
C��K+��CO32����Cl�� ��H+ D��H+��Na+��Cl����SO42��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014����ʡ�����и����꼶�����ο������ۻ�ѧ�Ծ��������棩 ���ͣ��ƶ���
��15�֣����㻯����A��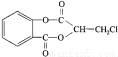 ����һ�������¿��Է�������ͼ��ʾ��ת�������������ˮ����ȥ����
����һ�������¿��Է�������ͼ��ʾ��ת�������������ˮ����ȥ����
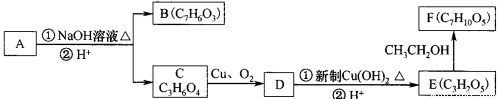
��ش��������⣺
��1��д��A�ķ���ʽ ��
��2��1 molA������������Һ�м��ȣ���ַ�Ӧ������������ mol ��
��3��д����E�Ƶ�F�Ļ�ѧ����ʽ�� �� ��Ӧ������ ��
��4���л���B��������(CH3COOCOCH3)ֱ�ӷ�Ӧ���Ƶð�˾ƥ�֣� 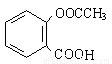
��������ˮ���ᣬ����ʽ C9H8O4�����������������İ�˾ƥ�ֵ�
ͬ���칹���� �֡��ٱ�����ֻ������������ ������������ ���ܷ���������Ӧ
���к˴Ź���������3:2:2:1�Ľṹ��ʽ�� �֡�
��5���л���C���������ᣨ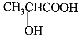 �����������л���Ӧ�Ƶã���д��������Ϊ��Ҫԭ���Ʊ��л���C�ĺϳ�·������ͼ(���Լ�����)���ϳ�·������ͼʾ�����£�
�����������л���Ӧ�Ƶã���д��������Ϊ��Ҫԭ���Ʊ��л���C�ĺϳ�·������ͼ(���Լ�����)���ϳ�·������ͼʾ�����£�
CH3CH2OH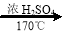 CH2��CH2
CH2��CH2 CH2CH3CH3
CH2CH3CH3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014����ʡ�����и����꼶�����ο������ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
������Ԫ��X��Y��Z��ԭ��������������YΪIA��Ԫ�أ�X��Zͬ���壬3��Ԫ��ԭ�ӵ�����������֮��Ϊ13�������ж���ȷ����
A��YԪ��λ�ڵ�2���� B��Y��Z������X�γɲ�ֻһ�ֻ�����
C��X�Ǣ�A��Ԫ�� D���⻯����ȶ��ԣ�HnZ �� HnX
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014����ʡ�����и�����ѧ��ͳ���������ۻ�ѧ�Ծ��������棩 ���ͣ��ƶ���
������F��һ����Ҫ���л��ϳ��м��壬���ĺϳ�·�����£�
��1��������F�к��������ŵ������� �� ����B����C�Ļ�ѧ��Ӧ������ ��
��2��д��������C�����ᷴӦ�������Ļ�ѧ����ʽ��
��3��д��������B�Ľṹ��ʽ ��
��4��ij��������D��ͬ���칹�壬�ҷ�����ֻ�����ֲ�ͬ��ѧ��������ԭ�ӡ�д����
������Ľṹ��ʽ (��дһ��)��
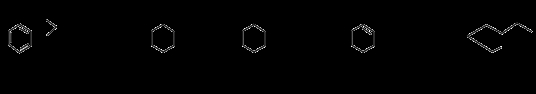
��5�����������֪ʶ����������Ϣ��д���Ա���(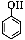 )��CH2��CH2Ϊԭ���Ʊ�
)��CH2��CH2Ϊԭ���Ʊ�
�л��� 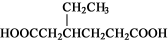 �ĺϳ�·������ͼ(���Լ�����)��
�ĺϳ�·������ͼ(���Լ�����)��
�ϳ�·������ͼʾ�����£�
H2C== CH2 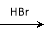 CH3CH2Br
CH3CH2Br  CH3CH2OH
CH3CH2OH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014����ʡ��������ѧ�����п��Ը߶���ѧ�Ծ��������棩 ���ͣ�ѡ����
����������

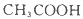
��1������NaOH��Һ��Ӧ����________����д��ţ���ͬ����
��2���ܷ���������Ӧ����________;
��3�����ܷ���������Ӧ�����ܷ�����ȥ��Ӧ����___________;
��4���ܺ�NaHCO3��Ӧ����______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014����ʡ�߶���ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
�����Ȼ�ѧ����ʽ����ȷ���ǣ�
A��4g��������ȫȼ������SO2���ų�37 kJ������S(s)+O2(g)=SO2(g) ��H= -296kJ/mol
B��1molN2��3molH2��ij�ܱ������з�Ӧ�ų�73kJ��������Ӧ���Ȼ�ѧ����ʽΪ��
N2(g)+3H2(g) 2NH3(g) ��H= -73kJ/mol
2NH3(g) ��H= -73kJ/mol
C������ı�ȼ����Ϊ-890.3kJ��mol-1�������ȼ�յ��Ȼ�ѧ����ʽ�ɱ�ʾΪ��CH4(g)+2O2(g) ==CO2(g)+ 2H2O(g) ��H=-890.3kJ��mol-1
D��ǿ��ǿ����к���Ϊ- 57.3 kJ/mol��
Ba(OH) 2(aq)+H2SO4(aq)=BaSO4(S)+2H2O(l) ��H=-114.6 kJ/mol
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com