
【题目】[化学—选修5:有机化学基础]
肉桂酸苄酯又名苯丙烯酸苄酯,常作为定香剂,也可用于香皂及食品香精的调香原料。以下是一种合成肉桂酸苄酯的路线。
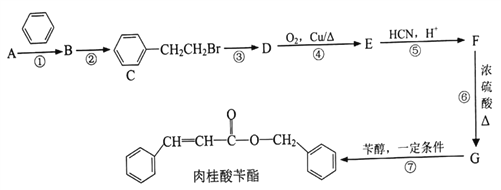
已知:I.相同条件下,烃A对氢气的相对密度为13
Ⅱ.反应①、反应②的原子利用率均为100%
III.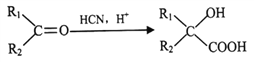
![]()
回答下列问题:
(1)A的名称为____________________。
(2)反应③的条件为____________________。
(3)上述合成路线涉及的反应中,属于取代反应的有___________________〔填编号)。
(4)写出反应D→E的化学方程式__________________________________。
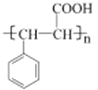
(5)写出G在一定条件下生成的高分子化合物的结构简式__________________。
(6)F同时满足下列条件的同分异构体共有__________种(不考虑立体异构)。
①苯环上有2个取代基
②能发生银镜反应和水解反应
③能与FeCl3溶液发生显色反应
其中核磁共振氢谱显示6组峰,且峰面积比为3:2:2:1:1:1的是___________(填结构简式)
(7)参照上述合成路线,以CH3CHO为原料,设计制备![]() 的合成线路(无机试剂及溶剂任选) __________________。
的合成线路(无机试剂及溶剂任选) __________________。
【答案】 乙炔 NaOH水溶液![]() 加热 ③⑦
加热 ③⑦ ![]()
![]() 6
6 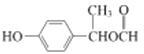
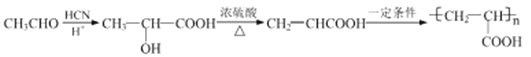
【解析】相同条件下,烃A对氢气的相对密度为13,则相对分子质量为26,故A为乙炔;反应①、反应②的原子利用率均为100%,为加成反应,故乙炔与苯发生加成反应生成B为苯乙烯,苯乙烯与溴化氢发生加成反应生成C(![]() ),
),![]() 在氢氧化钠的水溶液中加热发生取代反应生成D为
在氢氧化钠的水溶液中加热发生取代反应生成D为![]() ,
,![]() 在铜催化下氧化生成E为
在铜催化下氧化生成E为![]() ,根据已知III.
,根据已知III.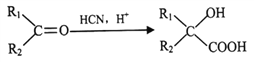 ,
,![]() 与HCN反应后酸化得到F为
与HCN反应后酸化得到F为![]() ,
,![]() 在浓硫酸催化下发生消去反应生成G为
在浓硫酸催化下发生消去反应生成G为![]() ,
,![]() 与苄醇发生酯化反应生成肉桂酸苄酯。(1)A的名称为乙炔;(2)反应③是
与苄醇发生酯化反应生成肉桂酸苄酯。(1)A的名称为乙炔;(2)反应③是![]() 在氢氧化钠的水溶液中加热发生取代反应生成
在氢氧化钠的水溶液中加热发生取代反应生成![]() ,反应条件为NaOH水溶液、加热;(3)反应①②⑤为加成反应,反应③⑦为取代反应,反应④为氧化反应,反应⑥为消去反应,故上述合成路线涉及的反应中,属于取代反应的有③⑦;(4)反应D→E是
,反应条件为NaOH水溶液、加热;(3)反应①②⑤为加成反应,反应③⑦为取代反应,反应④为氧化反应,反应⑥为消去反应,故上述合成路线涉及的反应中,属于取代反应的有③⑦;(4)反应D→E是![]() 在铜催化下氧化生成
在铜催化下氧化生成![]() ,反应的化学方程式为
,反应的化学方程式为![]() ;(5)G为
;(5)G为![]() ,在一定条件下发生加聚反应生成的高分子化合物的结构简式为
,在一定条件下发生加聚反应生成的高分子化合物的结构简式为 ;(6)F为
;(6)F为![]() ,①苯环上有2个取代基,②能发生银镜反应和水解反应含有醛基和酯基,③能与FeCl3溶液发生显色反应则含有酚羟基,分子中只有三个氧原子,故另外为甲酸酯的结构,满足条件的同分异构体苯环上除酚羟基个,另一取代基为HCOOCH/span>2CH2-或HCOOCH(CH3)-共2种,两取代基位置有邻、间、对位,故同分异构体共6种;其中核磁共振氢谱显示6组峰,且峰面积比为3:2:2:1:1:1的是
,①苯环上有2个取代基,②能发生银镜反应和水解反应含有醛基和酯基,③能与FeCl3溶液发生显色反应则含有酚羟基,分子中只有三个氧原子,故另外为甲酸酯的结构,满足条件的同分异构体苯环上除酚羟基个,另一取代基为HCOOCH/span>2CH2-或HCOOCH(CH3)-共2种,两取代基位置有邻、间、对位,故同分异构体共6种;其中核磁共振氢谱显示6组峰,且峰面积比为3:2:2:1:1:1的是 ;(7)参照上述合成路线, CH3CHO与HCN发生加成反应后酸化得到2-羟基丙酸, 2-羟基丙酸在浓硫酸催化下发生消去反应生成丙烯酸,丙烯酸在一定条件下发生加聚反应生成
;(7)参照上述合成路线, CH3CHO与HCN发生加成反应后酸化得到2-羟基丙酸, 2-羟基丙酸在浓硫酸催化下发生消去反应生成丙烯酸,丙烯酸在一定条件下发生加聚反应生成![]() ,合成线路如下:
,合成线路如下: 。
。


科目:高中化学 来源: 题型:
【题目】胶体区别于其它分散系的本质特征是
A.胶体分散质粒子直径介于1nm~100nm之间B.胶体能产生丁达尔现象
C.胶体是一种澄清透明的分散系D.胶体可用于净水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼镁泥主要成分是MgO(占40%),还含有Na2B4O7、CaO、Al2O3、Fe2O3、FeO、MnO、SiO2等杂质。以硼镁泥为原料制取MgSO4·7H2O的工艺流程如下:
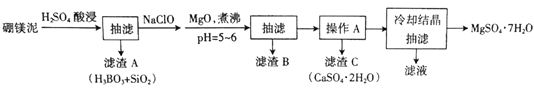
已知部分金属阳离子沉淀的pH:Fe(OH)3:3.2,Al(OH)3:5.2,Fe(OH)2:9.7,Mg(OH)2:11.2。
(1)为提高酸浸时浸出速率,可采取的措施有______________(写出两条)。
(2)H2SO4和Na2B4O7发生反应的化学方程式为________________。
(3)加入NaClO后可以生成一种不溶于水的黑色固体,则反应的离子方程式为_________。
(4)加MgO煮沸,并调整溶液pH=5~6的目的是_______________。
(5)已知MgSO4、CaSO4的溶解度如下表:
| 10℃ | 20℃ | 40℃ | 60℃ |
MgSO4 | 28.2 | 33.7 | 44.5 | 54.6 |
CaSO4 | 0.244 | 0.255 | 0.264 | 0.265 |
“操作A”是将MgSO4和CaSO4混合溶液中的CaSO4。除去,根据上表数据,步骤为________________,__________________。
(6)本实验中多次用到抽滤操作,其装置如图,相比普通过滤,抽滤的优点是____________________。
(7)实验中提供的硼镁泥共100g,得到MgSO4·7H2O为172.2g,则MgSO4·7H2O的产率为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z在元素周期表中的相对位置如下图所示,其中W的最高正价和最低负价的代数和为2。下列判断正确的是( )
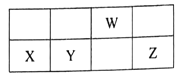
![]()
A. 最高价氧化物对应水化物的酸性:Y>W
B. 最简单气态氢化物的稳定性:Z>Y
C. 元素W与元素Y形成的化合物Y3W4是一种新型有机材料
D. X的单质能与W的最高价氧化物对应水化物的浓溶液反应产生氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作中,符合操作规范的是
A. 洒出的少量酒精在桌面上燃烧起来,立即用湿抹布盖灭
B. 测定溶液的pH,先用水润湿pH试纸,然后将试纸插入待测液中
C. 为了达到节约药品的目的,将实验后剩余的药品放回原瓶
D. 配制稀硫酸时,将水沿量筒壁慢慢注入浓硫酸中,并不断搅拌
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】其同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、Si02、A12O3),不考虑其他杂质)制取七水合硫酸亚铁(FeSO4·7H2O),设计了如图流程:
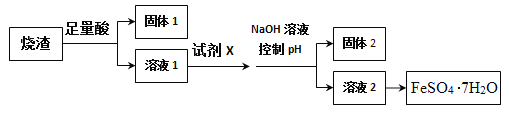
已知,某些金属阳离子可以通过“控制pH”[既调节溶液的酸碱性,pH=-lgc(H+)),pH值越大,碱性越强]使其转化为沉淀。固体2为白色沉淀。
(1)加足量酸之前,烧渣需经过进一步粉碎处理,粉碎的目的是__________。
(2)溶解烧渣选用的足量酸能否是盐酸,并说明理由_____。
(3)固体1有诸多用途,请列举其中一个____,试剂X的作用是______。
(4)某同学在控制pH这步操作时不慎将氢氧化钠溶液加过量了,结果得到的白色沉淀迅速转化为灰绿色,最终变为红褐色沉淀。请用化学用语解释固体2白色变成红褐色的原_____________。
(5)从溶液2中得到绿矾的过程中除需控制温度,防止产品分解外还应注意______。
(6)唐代苏敬《新修本草》对绿矾有如下描述:“本来绿色,新出窑未见风者,正如琉璃。陶及今人谓之石胆,烧之赤色。”另已知1mol绿矾隔绝空气高温煅烧完全分解,转移NA个电子。试写出绿矾隔绝空气高温煅烧分解的化学反应方程式____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.某温度时,在一个10L恒容容器中,X、Y、Z均为气体,三种物质的物质的量随时间的变化曲线如图所示。根据图中数据填空:

(1)该反应的化学方程式为_________________。
(2)反应开始至2min,以气体X表示的平均反应速率为________________。
(3)平衡时容器内气体的压强与起始时比________________(填“变大”,“变小”或“相等”下同),混合气体的密度与起始时比________________。
(4)将amolX与bmolY的混合气体发生上述反应,反应到某时刻各物质的量恰好满足:n(X)=n(Y)=2n(Z),则原混合气体中a:b=____。
Ⅱ.在恒温恒压的密闭容器中,当下列物理量不再发生交化时:①混合气体的压强;②混合气体的密度;③混合气体的总物质的量;④混合气体的平均相对分子质量;⑤各反应物或生成物的反应速率之比等于化学计量数之比
(1)一定能证明2NO2(g)![]() N2O4(g)达到平衡状态的是________(填序号,下同)。
N2O4(g)达到平衡状态的是________(填序号,下同)。
(2)一定能证明NH2COONH4(s)![]() CO2(g)+2NH3(g)达到平衡状态的是______。
CO2(g)+2NH3(g)达到平衡状态的是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 1 L 0.5 mol/L Na2CO3溶液中含有的CO32-数目为0.5NA
B. 物质的量浓度为0.5mol/LAlCl3溶液中,含有Cl-个数为1.5NA
C. 6g乙烷中含有的共价键的数目为1.4NA
D. l mol甲基(- CH3)所含电子数为10NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com