
【题目】化合物H是一种光伏材料中间体。工作室由芳香化合物A制备H的一种合成路线如下:

已知:①RCHO+CH3CHO ![]() RCH=CHCHO+H2O
RCH=CHCHO+H2O
②![]()
回答下列问题
(1)B所含官能团名称为___________。
(2)由B生成C和E生成F的反应类型分别为___________、___________。
(3)D的结构简式为___________。
(4)由A生成B的化学方程式为___________。
(5)芳香化合物X是F的同分异构体,X能与饱和碳酸氢钠溶液反应放出CO2,其核磁共振氢谱显示有4种不同化学环境的氢,峰面积比为6:2:1:1,符合要求的X的结构有___________种,写出其中一种结构简式___________。
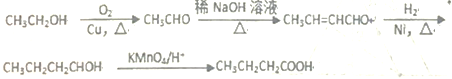
(6)根据已有知识并结合相关信息,写出以乙醇为原料合成 CH3CH2CH2COOH的合成路线(无机试剂在用)(合成路线示例如下:CH2=CH2![]() CH3CH2Br
CH3CH2Br![]() CH3CH2OH ______________________________________________。
CH3CH2OH ______________________________________________。
【答案】碳碳双键、醛基 氧化反应 取代反应(或酯化反应) ![]()
![]() 4种
4种 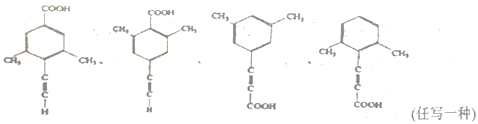
【解析】
芳香族化合物A与乙醛发生信息①中的反应生成B,A含有醛基,反应中脱去1分子水,由原子守恒可知A的分子式为:C9H8O+H2O-C2H4O=C7H6O,故A为![]() ,则B为
,则B为![]() ,B发生氧化反应、酸化得到C为
,B发生氧化反应、酸化得到C为![]() .C与溴发生加成反应得到D为
.C与溴发生加成反应得到D为![]() ,D发生消去反应、酸化得到E为
,D发生消去反应、酸化得到E为![]() .E与乙醇发生酯化反应生成F为
.E与乙醇发生酯化反应生成F为![]() .结合信息②中的加成反应、H的结构简式,可推知G为
.结合信息②中的加成反应、H的结构简式,可推知G为 ,以此解答(1)~(5);
,以此解答(1)~(5);
(6)利用信息①增长碳链,乙醇催化氧化生成乙醛,2分子乙醛反应得到CH3CH=CHCHO,再与氢气发生反应得到CH3CH2CH2CH2OH,最后用酸性高锰酸钾溶液氧化得到CH3CH2CH2COOH。
(1)由分析可知,B为![]() ,所含官能团名称为碳碳双键和醛基。
,所含官能团名称为碳碳双键和醛基。
(2)![]() 发生氧化反应生成的C为
发生氧化反应生成的C为![]() ;E为
;E为![]() ,其与乙醇发生酯化反应生成的F为
,其与乙醇发生酯化反应生成的F为![]() ,反应类型为取代反应;
,反应类型为取代反应;
(3)由分析可知D的结构简式为![]() ;
;
(4)A为![]() ,与乙醛在NaOH的水溶液中发生反应生成的B为
,与乙醛在NaOH的水溶液中发生反应生成的B为![]() ,反应的化学方程式为
,反应的化学方程式为![]() ;
;
(5)F为![]() ,芳香化合物X是F的同分异构体,X能与饱和碳酸氢钠溶液反应放出CO2,说明含有羧基,其核磁共振氢谱显示有4种不同化学环境的氢,峰面积比为6:2:1:1,则分子中应含有2个甲基,且为对称结构,符合条件的结构有4种,分别是
,芳香化合物X是F的同分异构体,X能与饱和碳酸氢钠溶液反应放出CO2,说明含有羧基,其核磁共振氢谱显示有4种不同化学环境的氢,峰面积比为6:2:1:1,则分子中应含有2个甲基,且为对称结构,符合条件的结构有4种,分别是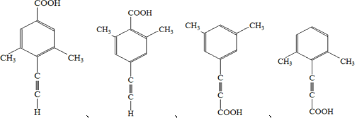 ;
;
(6)利用信息①增长碳链,乙醇催化氧化生成乙醛,2分子乙醛反应得到CH3CH=CHCHO,再与氢气发生反应得到CH3CH2CH2CH2OH,最后用酸性高锰酸钾溶液氧化得到CH3CH2CH2COOH.合成路线流程图为: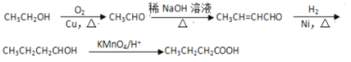 。
。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是

A. 用上图所示方法可保护钢闸门不被腐蚀
B. SiO2(s)+2C(s)=Si(s)+2CO(g)在常温下不能自发进行,则该反应的△H>0
C. 常温下,NH4Cl溶液加水稀释,![]() 增大
增大
D. C(s)+H2O(g)![]() CO(g)+H2(g)(△H>0),其它条件不变时,升高温度,正反应速率增大、逆反应速率减小,平衡正向移动
CO(g)+H2(g)(△H>0),其它条件不变时,升高温度,正反应速率增大、逆反应速率减小,平衡正向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】萜类化合物广泛存在于动植物体内,关于下列萜类化合物的说法正确的是

A. a和b都属于芳香族化合物 B. b和c都能与新制Cu(OH)2溶液反应
C. a、b和c均能使酸性KMnO4溶液褪色 D. b和c互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用如下图所示装置(I)制取溴苯和溴乙烷。已:溴乙烷为无色液体,难溶于水,沸点38.4℃,熔点一119℃,密度为1.64g·cm-3。主要实验步骤如下:

①检查气密性后,向烧瓶中加入一定量苯和液溴。
②向锥型瓶中加入乙醇和浓H2SO4的混合液至恰好没过进气导管口。
③将A装置中纯铁丝小心向下插入混合液中。
④点燃B装置中酒精灯,用小火缓缓对锥形瓶加热10分钟。
请填写下列空白:
(1)A装置中发生的反应的化学方程式________________________________
(2)导管a的作用是_______________。
(3)C装置中U型管的内部用蒸馏水封住管底的作用是___________________________。
(4)反应完毕后,分离出溴乙烷时所用最主要仪器名称是(只填一种)_____________。
(5)步骤④中可否用大火加热,理由是____________________________________。
(6)为证明溴和苯的上述反应是取代而不是加成反应。该学生用装置(Ⅱ)代替装置B、C直接与A相连接重新反应,锥形瓶里盛放的液体为AgNO3溶液。
①装置(Ⅱ)的锥形瓶中小试管内的液体是____________(填名称),其作用为_______________
②能证明溴和苯的反应是取代反应的现象为_________________________;装置(Ⅱ)还可起到的作用是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是

A. 25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)将减小
B. 一定温度下,反应“2HI(g)![]() H2(g)+I2(g) △H>0”能自发进行,则该反应△S>0
H2(g)+I2(g) △H>0”能自发进行,则该反应△S>0
C. 向滴有酚酞的Na2CO3溶液中滴加BaCl2溶液,红色逐渐褪去,说明BaCl2溶液显酸性
D. 上图电池放电时的正极反应式:2Li++Li2O2+2e—=2Li2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个容积相同的恒容密闭容器中按不同方式投入反应物,发生反应2SO2(g)+ O2(g) ![]() 2SO3(g)(正反应放热),测得反应的相关数据如下:
2SO3(g)(正反应放热),测得反应的相关数据如下:
容器1 | 容器2 | 容器3 | |
反应温度T/K | 700 | 700 | 800 |
反应物投入量 | 2molSO2、1molO2 | 4molSO3 | 2molSO2、1molO2 |
平衡v正(SO2)/mol·L-1·s-1 | v1 | v2 | v3 |
平衡c(SO3)/mol·L-1 | c1 | c2 | c3 |
平衡体系总压强p/Pa | p1 | p2 | p3 |
物质的平衡转化率a | α1 (SO2) | α2 (SO3) | α3 (SO2) |
平衡常数K | K1 | K2 | K3 |
下列说法正确的是
A. v1<v2,c2< 2c1 B. K1>K3,p2> 2p3
C. v1<v3,α1(SO2) <α3(SO2) D. c2> 2c3,α2(SO3)+α3(SO2)<1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是原子序数依次增大的四种短周期主族元素。W的气态氢化物水溶液能刻蚀玻璃,X为同周期中原子半径最大的元素,Y的单质在常温下遇浓硫酸钝化,Z与W同主族。回答下列问题:
(l)W在元素周期表中的位置是____。
(2)Z的单质与水反应生成含氧酸分子的电子式为____。
(3)X的最高价氧化物对应水化物溶液与Y的单质反应,其反应的离子方程式为____。
(4)不能通过加热Y与Z形成的化合物水溶液而得到其固体的原因是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的数值,下列说法中正确的是( )
①0.5molO3与11.2LO2所含的分子数一定相等
②标准状况下,22.4L氯气与足量铝充分反应,转移的电子数为3NA
③通常状况下,NA 个CO2分子占有的体积为22.4L
④常温常压下,92g的NO2和N2O4混合气体含有的原子数为6NA
⑤常温下,4.4g CO2和N2O(不反应)混合物中所含有的原子数为0.3 NA
⑥在反应KIO3+6HI===KI+3I2+3H2O中,每生成3molI2转移的电子数为6NA
⑦标准状况下,22.4 L SO3含有的分子数为NA
⑧在常温常压下,1 mol O2含有的原子数为2NA.
⑨物质的量浓度为0.5 mol·L-1 MgCl2溶液中,含有Cl-个数为NA
⑩将100 mL 0.1 mol·L-1的FeCl3溶液滴入沸水中可制得Fe(OH)3胶粒数目为0.01NA
A. ①②④⑧B. ④⑤⑧C. ③⑥⑨⑩D. ④⑤⑧⑨
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铍铜是力学、化学综合性能良好的合金,广泛应用于制造高级弹性元件。以下是从某废旧铍铜元件(含BeO25%、CuS71%、少量FeS和SiO2)中回收铍和铜两种金属的流程。
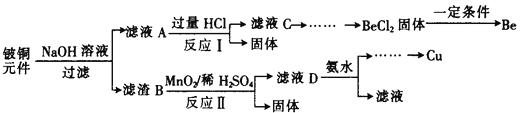
已知:I.铍、铝元素处于周期表中的对角线位置,化学性质相似
Ⅱ.常温下:Ksp[Cu(OH)2]=2.2×10![]() Ksp[Fe(OH)3]=4.0×10
Ksp[Fe(OH)3]=4.0×10![]() Ksp[Mn(OH)2]=2.1×10
Ksp[Mn(OH)2]=2.1×10![]()
(1)滤液A的主要成分除NaOH外,还有______________ (填化学式),
写出反应I中含铍化合物与过量盐酸反应的离子方程式____________________________。
(2)溶液C中含NaCl、BeCl2和少量HCl,为提纯BeCl2,选择合理步骤并排序___________。
a.加入过量的 NaOH b.通入过量的CO2 c.加入过量的氨水
d.加入适量的HCl e.过滤 f.洗涤
(3)①MnO2能将金属硫化物中的硫元素氧化为单质硫,写出反应Ⅱ中CuS发生反应的化学方程式________________________________________________________。
②若用浓HNO3溶解金属硫化物,缺点是______________ (任写一条)。
(4)溶液D中含c(Cu2+)=2.2mol·L-1、c(Fe3+)=0.008mol·L-1、c(Mn2+)=0.01mol·L-1,逐滴加入稀氨水调节pH可依次分离,首先沉淀的是________________ (填离子符号),为使铜离子开始沉淀,常温下应调节溶液的pH值大于______________。取铍铜元件1000g,最终获得Be的质量为81g,则产率是______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com