
| A. | 原电池的正极材料必须是金属 | |
| B. | 原电池的负极发生还原反应 | |
| C. | 实验室欲快速制取氢气,可利用粗锌与稀硫酸反应 | |
| D. | 原电池可以把物质内部的能量全部转化为电能 |
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
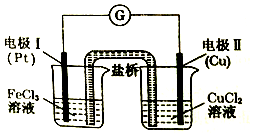
| A. | 盐桥中装有含氯化钾的琼脂,K+移向左池,Cl-移向右池 | |
| B. | 电极I上发生还原反应,电极反应式:Fe3++3e-=Fe | |
| C. | 电极Ⅱ作负极,铜电极逐渐溶解 | |
| D. | 该原电池的总反应为2 Fe3++Cu=Cu2++2Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 沸水中滴入FeCl3饱和溶液:Fe3++3H2O$\frac{\underline{\;△\;}}{\;}$Fe(OH)3↓+3H+ | |
| B. | 氯气和水反应:Cl2+H2O═2H++Cl-+ClO- | |
| C. | 用氢氧化钠溶液吸收过量二氧化碳:OH-+CO2═HCO${\;}_{3}^{-}$ | |
| D. | Fe(OH)3溶于氢碘酸中:Fe(OH)3+3H+═Fe3++3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 组分 | SiO2 | C | Na2O | K2O | Al2O3 | Fe2O3 |
| 质量分数/% | 59.20 | 38.80 | 0.25 | 0.50 | 0.64 | 0.16 |
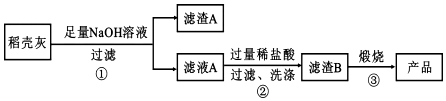
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
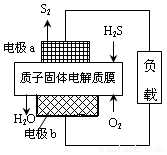 工业废气H2S经资源化利用后可回收能量并得到单质硫.反应原理为:2H2S(g)+O2(g)=S2(s)+2H2O(l)△H=-632kJ•mol-1.H2S燃料电池的工作原理如图所示.下列说法不正确的是( )
工业废气H2S经资源化利用后可回收能量并得到单质硫.反应原理为:2H2S(g)+O2(g)=S2(s)+2H2O(l)△H=-632kJ•mol-1.H2S燃料电池的工作原理如图所示.下列说法不正确的是( )| A. | 电极a为电池的正极 | |
| B. | 电极b上发生的电极反应为O2+4H++4e-=2H2O | |
| C. | 若电路中通过2mol电子,则电池内部释放632kJ热能 | |
| D. | 若有17gH2S参与反应,则会有1molH+经质子膜进入正极区 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向含有少量KSCN的FeI2溶液中滴加少量溴水,溶液出现血红色 | |
| B. | 用NH4HCO3固体以及其他固体药品能制得纯净的NH3 | |
| C. | 将SO2通入酸性KMnO4溶液中,溶液褪色,体现了SO2的漂白性 | |
| D. | 加热条件下,过量的Fe与浓硫酸反应只生成SO2一种气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com